В сосуде неизменного объема при комнатной

9067. Горячая жидкость медленно охлаждалась в стакане. В таблице приведены результаты измерений ее температуры с течением времени.
Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенного экспериментального исследования, и укажите их номера.
1. Через 9 мин после начала измерений в стакане находилось вещество как в жидком, так и в твердом состоянии.2. Через 13 мин после начала измерений в стакане находилось вещество только в твердом состоянии.3. Температура кристаллизации жидкости в данных условиях равна 95 °С.4. Через 10 мин после начала измерений жидкость начала конденсироваться.5. Через 7 мин после начала измерений в стакане находилось вещество только в жидком состоянии.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9067.
9099. В сосуде неизменного объема при комнатной температуре находилась смесь водорода и гелия по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль водорода. Считая газы идеальными, а их температуру постоянной, выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных исследований, и укажите их номера.
1. Концентрация гелия увеличилась.2. В начале опыта концентрации газов были одинаковые.3. Парциальное давление водорода уменьшилось.4. В начале опыта массы газов были одинаковые.5. Давление смеси газов в сосуде не изменилось.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9099.
9131. В сосуде неизменного объема при комнатной температуре находилась смесь водорода и гелия, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль гелия. Считая газы идеальными, а их температуру постоянной, выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных исследований, и укажите их номера.
1. Концентрация водорода увеличилась.2. В начале опыта концентрация водорода была больше, чем концентрация гелия.3. Парциальное давление водорода уменьшилось.4. В начале опыта масса гелия была больше, чем масса водорода.5. Давление смеси газов в сосуде уменьшилось.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9131.
9163. Относительная влажность воздуха в закрытом сосуде с поршнем равна 40%. Объем сосуда за счет движения поршня медленно уменьшают при постоянной температуре. В конечном состоянии объем сосуда в 3 раза меньше начального.
Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных наблюдений, и укажите их номера.
1. В конечном и начальном состояниях масса пара в сосуде одинакова.2. При уменьшении объема в 2 раза относительная влажность воздуха в сосуде стала равна 80%.3. При уменьшении объема сосуда в 2,5 раза на стенках появляется роса.4. В конечном состоянии весь пар в сосуде сконденсировался.5. Давление пара в сосуде все время увеличивается.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9163.
9195. Относительная влажность воздуха в закрытом сосуде с поршнем равна 50%. Объем сосуда за счет движения поршня медленно уменьшают при постоянной температуре. В конечном состоянии объем сосуда в 4 раза меньше начального.
Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных наблюдений, и укажите их номера.
1. В конечном состоянии весь пар в сосуде сконденсировался.2. После уменьшения объема в 3 раза относительная влажность воздуха в сосуде равна 150%.3. Плотность пара в сосуде все время увеличивается.4. В конечном состоянии масса пара в сосуде в 2 раза меньше начальной массы пара.5. Давление пара сначала увеличивается, а затем остается постоянным.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9195.
9227. В цилиндре под поршнем находится твердое вещество. Цилиндр поместили в раскаленную печь. На рисунке показан график изменения температуры (t ) вещества по мере поглощения им количества теплоты (Q ). Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных наблюдений, и укажите их номера.
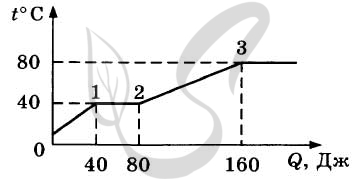
1. Теплоемкость вещества в жидком состоянии меньше, чем в твердом.2. Для того чтобы полностью расплавить вещество, уже находящееся при температуре плавления, ему надо передать 40 Дж теплоты.3. Температура плавления вещества равна 80 °С.4. На участке 2-3 происходит переход вещества в газообразное состояние.5. В состоянии 2 вещество полностью расплавилось.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9227.
9259. В цилиндре под поршнем находится твердое вещество. Цилиндр поместили в раскаленную печь. На рисунке показан график изменения температуры (t ) вещества по мере поглощения им количества теплоты (Q ). Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных наблюдений, и укажите их номера.
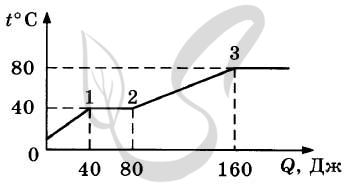
1. Теплоемкость вещества в жидком состоянии больше, чем в твердом.2. Для того чтобы полностью расплавить вещество, уже находящееся при температуре плавления, ему надо передать 80 Дж теплоты.3. Температура кипения вещества равна 80 °С.4. На участке 2-3 происходит переход вещества в жидкое состояние.5. В состоянии 1 вещество полностью расплавилось.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9259.
9291. На рисунке приведены графики двух изотермических процессов, проводимых с одной и той же массой газа. На основании графиков выберите два верных утверждения о процессах, происходящих с газом.
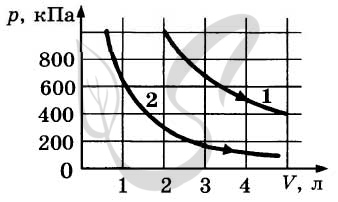
1. Процесс 1 идет при более высокой температуре.2. Процесс 2 идет при более высокой температуре.3. Оба процесса идут при одной и той же температуре.4. В процессе 1 объем увеличивается.5. В процессе 1 внутренняя энергия газа увеличивается.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9291.
9323. На. рисунке приведены графики двух изотермических процессов, проводимых с одной и той же массой газа. На основании графиков выберите два верных утверждения о процессах, происходящих с газом.
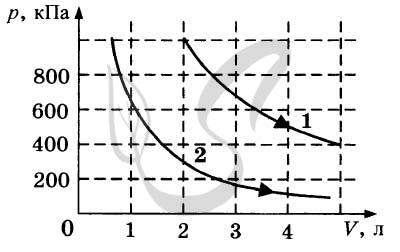
1. Процесс 1 идет при более низкой температуре.2. Процесс 2 идет при более низкой температуре.3. Оба процесса идут при одной и той же температуре.4. В процессе 1 давление уменьшается.5. В процессе 2 внутренняя энергия газа уменьшалась.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9323.
9355. При изучении процессов, происходящих с газом, ученик занес в таблицу результаты измерения температуры и давления одного и того же количества газа в различных равновесных состояниях. Какие два из приведенных ниже утверждений соответствуют результатам этих опытов? Газ считать идеальным.
1. Внутренняя энергия газа в опыте № 6 в 3 раза больше, чем в опыте 5.2. При переходе от состояния 2 к состоянию 3 газ получал тепло.3. Объем газа в состоянии 4 в 2 раза меньше объема газа в состоянии 1.4. При переходе от состояния 5 к состоянию 6 газ совершал работу.5. В опытах № 4-7 объем газа был одинаковым.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 9355.
Для вас приятно генерировать тесты, создавайте их почаще
Источник
Вначале оба идеальных газа в сосуде находились в полностью равных условиях. Полное количество вещества было равно 2 моля. Когда выпустили половину содержимого сосуда, и количество первого газа, и количество второго газа уменьшилось, в сосуде остался 1 моль газов. Затем в сосуд добавили еще 1 моль первого газа. Количество вещества вновь стало равно 2 моля. Следовательно, давление смеси газов в сосуде не изменилось, поскольку оно определяется только полной концентрацией молекул в сосуде. Парциальные давления газов, напротив, изменились. Первого газа стало больше, чем 1 моль, значит, его парциальное давление увеличилось. Второго газа стало меньше, чем 1 моль: парциальное давление второго газа уменьшилось.
«давление смеси газов в сосуде не изменилось, поскольку оно определяется только полной концентрацией молекул в сосуде»
мы же не знаем пропорции и концентрации газов, как можно тогда считать что давление не изменилось?
Отношение между получившимися концентрациями знать и не нужно. Существенно только, что температура остается неизменной.
Смотрите. Обозначим объем сосуда через
В сосуде неизменного объема находится идеальный газ. Часть газа выпускали из сосуда так, что давление оставалось неизменным. Как изменились при этом температура газа, оставшегося в сосуде, его плотность и количество вещества?
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Поскольку из сосуда выпускают часть газа, количество вещества в сосуде уменьшается. При этом плотность газа также уменьшается, так как теперь прежний объем занимает меньшая масса газа:
Объясните пожалйуста,почему температура увеличивается,ведь давление остается постоянным
Если температура будет увеличиваться, тогда получится, что правая часть(URT) уравнения Клапейрона-Менделлева больше левой(PV), а они должны быть равны.
По условию: «Часть газа выпускали из сосуда».
(При этом плотность газа также уменьшается, так как теперь прежний объем занимает меньшая масса газа: p=mV)
По условию: «В сосуде неизменного объема находится идеальный газ».
В сосуде неизменного объема находилась при комнатной температуре смесь двух идеальных газов, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль первого газа. Как изменились в результате парци-альные давления газов и их суммарное давление, если температура газов в сосуде поддерживалась неизменной? Для каждой величины определите соответствующий характер изменения:
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Парциальное давление первого газа | Парциальное давление второго газа | Давление смеси газов Вначале оба идеальных газа в сосуде находились в полностью равных условиях. Полное количество вещества было равно 2 моля. Когда выпустили половину содержимого сосуда, и количество первого газа, и количество второго газа уменьшилось, в сосуде остался 1 моль газов. Затем в сосуд добавили еще 1 моль первого газа. Количество вещества вновь стало равно 2 моля. Следовательно, давление смеси газов в сосуде не изменилось, поскольку оно определяется только полной концентрацией молекул в сосуде. Парциальные давления газов, напротив, изменились. Первого газа стало больше, чем 1 моль, значит, его парциальное давление увеличилось. Второго газа стало меньше, чем 1 моль: парциальное давление второго газа уменьшилось. «давление смеси газов в сосуде не изменилось, поскольку оно определяется только полной концентрацией молекул в сосуде» мы же не знаем пропорции и концентрации газов, как можно тогда считать что давление не изменилось? Отношение между получившимися концентрациями знать и не нужно. Существенно только, что температура остается неизменной. Смотрите. Обозначим объем сосуда через . Изначально обоих газов по 1 моль, то есть число молекул каждого газа равно числу Авагадро . То есть парциальные давления равны: , . Полное давление: После выпускания газов,число молекул первого и второго газов уменьшилось до и соответственно. При этом , поскольку всего в сосуде остался 1 моль. Теперь добавляют 1 моль первого газа, следовательно, число молекул становится и . Теперь . Тогда парциальное давление первого газа после всех операций: . Парциальное давление второго газа: . Новое общее давление: . спасибо большое, тоесть В сосуде неизменного объема находится идеальный газ. Если часть газа выпустить из сосуда при постоянной температуре, то как изменятся величины: давление газа, его плотность и количество вещества в сосуде? Для каждой величины определите соответствующий характер ее изменения: Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Поскольку из сосуда выпускают часть газа, количество вещества в сосуде уменьшается. При этом плотность газа также уменьшается, так как теперь прежний объем занимает меньшая масса газа: Макроскопические параметры газа не независимы, они связаны уравнением Клапейрона — Менделеева: Согласно условию, температура содержимого газа не изменяется, объем сосуда также постоянен, следовательно, давление в сосуде после выпускания части газа уменьшается. Немного не поняла с доказательством изменения давления газа. Я исходила из объединенного газового закона, где при постоянных объеме и температуре, выходит, что давление тоже неизменно.. Помогите разрешить этот казус) Не очень понимаю, что Вы называете объединенным газовым законом. Если , то ответ на Ваш вопрос очень прост. Этот закон попросту нельзя здесь использовать, как и любой другой газовый закон (Бойля-Мариотта, Гей-Люссака, Шарля), поскольку они верны только для постоянного количества вещества,а у нас количество вещества изменяется. Закон , на самом деле, ведь просто следствие уравнения Клапейрона-Менделеева в случае, если . Действительно, . Таким образом, данный закон неформально можно называть законом «изоколичества вещества». А закон Шарля — это «изобрано/изоколичественный» закон. В сосуде неизменного объема при комнатной температуре находилась смесь водорода и гелия, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль водорода. Считая газы идеальными, а их температуру постоянной, выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных исследований, и укажите их номера. 1) Парциальное давление водорода уменьшилось. 2) Давление смеси газов в сосуде не изменилось. 3) Концентрация гелия увеличилась. 4) В начале опыта концентрации газов были одинаковые. 5) В начале опыта массы газов были одинаковые. Вначале сосуде находилась смесь 1 моль водорода и 1 моль гелия. После выпускания половины содержимого сосуда в нём стало 0,5 моль водорода и 0,5 моль гелия. Затем в сосуд добавили 1 моль водорода, в нём стало 1,5 моль водорода и 0,5 моль гелия. Объём сосуда и температура по условию постоянны. 1) Количество водорода увеличилось, значит, его парциальное давление увеличилось. 2) Общее количество вещества одинаково (2 моль), давление смеси газов в сосуде не изменилось. 3) Количество гелия уменьшилось, значит, его концентрация уменьшилась. 4) В начале опыта количество вещества водорода и гелия было одинаковым, концентрации газов были одинаковые. 5) Молярные массы водорода и гелия разные, при одинаковом количестве вещества массы газов были разными. Верны второе и четвёртое утверждения. В сосуде неизменного объема при комнатной температуре находилась смесь водорода и гелия, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль гелия. Считая газы идеальными, а их температуру постоянной, выберите из предложенного перечня два утверждения, которые соответствуют результатам проведенных экспериментальных исследований, и укажите их номера. 1) Парциальное давление водорода уменьшилось. 2) Давление смеси газов в сосуде уменьшилось. 3) Концентрация водорода увеличилась. 4) В начале опыта концентрации водорода была больше, чем концентрация гелия. 5) В начале опыта масса гелия была больше, чем масса водорода. Вначале сосуде находилась смесь 1 моль водорода и 1 моль гелия. После выпускания половины содержимого сосуда в нём стало 0,5 моль водорода и 0,5 моль гелия. Затем в сосуд добавили 1 моль гелия, в нём стало 0,5 моль водорода и 1,5 моль гелия. Объём сосуда и температура по условию постоянны. 1) Количество водорода уменьшилось, значит, его парциальное давление уменьшилось. 2) Общее количество вещества одинаково (2 моль), давление смеси газов в сосуде не изменилось. 3) Количество водорода уменьшилось, значит, его концентрация уменьшилась. 4) В начале опыта количество вещества водорода и гелия было одинаковым, концентрации газов были одинаковые. 5) Молярная масса гелия больше, чем у водорода, при одинаковом количестве вещества масса гелия больше. Верны первое и пятое утверждения. В сосуде неизменного объёма находится идеальный газ. Во сколько раз нужно увеличить количество газа в сосуде, чтобы после уменьшения абсолютной температуры газа в 2 раза его давление стало вдвое больше начального? Из уравнения Менделеева—Клапейрона: Следовательно, для увеличения давления в два раза после уменьшения в два раза температуры газа нужно увеличить количество газа в сосуде в 4 раза. В сосуде неизменного объёма находится идеальный газ. Во сколько раз нужно уменьшить количество вещества газа в сосуде, чтобы после увеличения абсолютной температуры газа в 2 раза его давление стало вдвое меньше начального? Из уравнения Менделеева—Клапейрона: Следовательно, для уменьшения давления в два раза после увеличения в два раза температуры газа нужно уменьшить количество газа в сосуде в 4 раза. В сосуде неизменного объёма находится разреженный газ в количестве 3 моль. Во сколько раз уменьшится давление газа в сосуде, если выпустить из него 1 моль газа, а абсолютную температуру газа уменьшить в 2 раза? Согласно уравнению Менделеева — Клапейрона давление разреженного газа равно При уменьшении количества вещества газа на треть и абсолютной температуры в 2 раза давление уменьшится в 3 раза. Среднеквадратичная скорость молекул идеального одноатомного газа, заполняющего закрытый сосуд, равна Как и на сколько изменится среднеквадратичная скорость молекул этого газа, если давление в сосуде вследствие охлаждения газа уменьшить на 19%? Среднеквадратичная скорость молекул идеального газа при температуре равна где — постоянная Больцмана, — масса одной молекулы этого газа. Учитывая соотношение , где — универсальная газовая постоянная, — молярная масса газа, — постоянная Авогадро, выразим среднеквадратичную скорость молекул в виде Согласно уравнению Клапейрона — Менделеева где р — давление газа, V — объем сосуда, — масса газа. Из этих выражений следует, что Тогда начальная и конечная среднеквадратичная скорости равны и здесь учтено, что изменение давления в сосуде происходит при неизменном объёме (сосуд закрытый). Согласно условию задачи, Следовательно, Отсюда следует, что изменение среднеквадратичной скорости молекул Таким образом, среднеквадратичная скорость молекул газа уменьшится на 45 м/с. Ответ: среднеквадратичная скорость молекул газа уменьшится на 45 м/с. Приведём другое решение. Запишем основное уравнение МКТ, для первого и второго состояний газа: Объём сосуда и число молекул в нём не изменяются, следовательно, концентрация остаётся неизменной. Получаем: Откуда Ответ: Источник ➤ Adblock |
Источник
