В сосуде объем которого v 10 л находится

2017-10-13 ![]()
Два сосуда объемом $V = 10 л$ каждый наполнены сухим воздухом при давлении $V = 1 атм$ и температуре $t_{0} = 0^{ circ} С$. В первый вводят $m_{1} = 3 г$ воды, во второй $m_{2} = 15 г$ и нагревают сосуды до температуры $t = 100^{ circ} С$. Определить давление влажного воздуха при этой температуре в каждом сосуде.
Решение:
Введенная в сосуд вода испаряется, и давление в сосуде согласно закону Дальтона становится равным сумме парциальных давлений воздуха и паров воды.
Парциальное давление воздуха $p$ в обоих сосудах одинаково и легко находится с помощью закона Шарля, так как нагревание неизменной массы воздуха происходит при постоянном объеме (ибо тепловым расширением сосуда можно пренебречь):
$p = p_{0} T/T_{0} = 1 атм cdot 373 К/273 К= 1,37 атм$.
Теперь определим парциальное давление $p_{1}$ водяного пара в первом сосуде при $100^{ circ} С$. Для этого воспользуемся уравнением Менделеева — Клапейрона
$p_{1} = frac{1}{V} frac{m_{1}}{ mu} RT$. (1)
Подставляя в (1) числовые значения всех величин ($R = 0,082 атм cdot л/(моль cdot ^{ circ}С), mu = 0,018 кг/моль$), находим $p_{1} = 0,51 атм
Подсчитав таким же образом парциальное давление водяного пара во втором сосуде, получим $p_{2} = 2,55 атм > 1 атм$.
Итак, казалось бы, полное давление во втором сосуде
$p + p_{2} = 3,92 атм$.
Но не будем торопиться. Подумаем, может ли давление водяного пара при $100^{ circ} С$ быть больше 1 атм. Вспомним, что при давлении 1 атм вода кипит при $100^{ circ} С$. Это значит, что давление насыщенного водяного пара равно 1 атм при $100^{ circ} С$. Другими словами, давление водяного пара при $100^{ circ} С$ при наличии свободной поверхности жидкости никогда не может превышать 1 атм. Поэтому во втором сосуде вода испарилась не полностью, пар будет насыщенным и его парциальное давление равно 1 атм. Полное давление в этом сосуде $ p + 1 атм = 2,37 атм$.
Подумайте теперь, как можно подсчитать массу неиспарившейся воды во втором сосуде.
При решении этой задачи для нахождения давления водяного пара мы использовали закон Менделеева — Клапейрона — уравнение состояния идеального газа. Это можно делать для достаточно разреженного пара независимо от того, является ли он насыщенным или нет. Однако содержание закона в этих двух случаях совершенно различно. Если пар далек от насыщения, то, используя уравнение (1), мы находим давление пара, которое оказывается весьма близким к наблюдаемому на опыте. Для насыщенного пара использование этого уравнения для нахождения давления приводит, как мы только что видели, к абсурду. Однако это не означает, что закон неверен. Если вычисленное по уравнению (1) давление водяного пара оказывается больше, чем давление насыщенного пара при данной температуре, то это означает, что на самом деле масса пара меньше той, которую мы подставляли в уравнение,— часть вещества находится в жидкой фазе. Подставляя в формулу (1) давление насыщенного пара, взятое из таблиц, можно из нее найти массу насыщенного пара, содержащегося в объеме $V$ при температуре $T$.
Таким образом, применяя уравнение Менделеева — Клапейрона к парам, нужно все время иметь под рукой таблицу зависимости давления насыщенного пара от температуры, т. е. зависимости температуры кипения от давления.
Теперь вы без труда сможете ответить на поставленный дополнительный вопрос — определить массу неиспарившейся воды во втором сосуде.
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
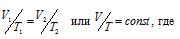
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
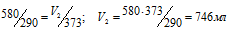
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:

Обозначив искомое давление газа через Р2, можно записать:
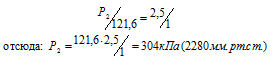
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:

По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
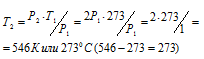
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
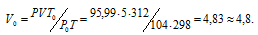
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
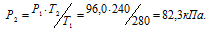
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
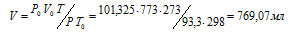
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
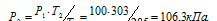
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
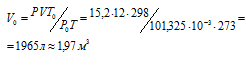
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
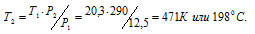
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
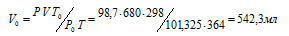
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:

где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
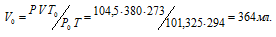
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
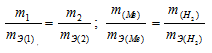
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
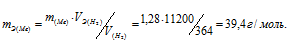
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
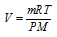
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
С. Р. 10 класс. Тема» МКТ идеального газа»
Вариант 1.
1. В сосуде объемом 8,3м3 находится 0,04 кг гелия при температуре 127о С. Молярная масса гелия 4∙10-3 кг/моль. Определить его давление.
2.Газ при температуре С занимает объем 0,6 л. Какой объем займет этот газ при температуре С и постоянном давлении?
3. В баллоне ёмкостью 50 л находится 120 моль одноатомного идеального газа при давлении 6,0 МПа. Определить среднюю кинетическую энергию теплового движения молекул газа.
Вариант 2.
1.Определите массу водорода, находящегося в баллоне вместимостью 20 м3 под давлением 830 Па при температуре 17о С. Молярная масса водорода 2∙10-3 кг/моль.
2. Газ нагрет от 27°С до 477° С при постоянном давлении. В результате его объем увеличился на 5 л. Определить первоначальный объем газа.
3. Определить средний квадрат скорости молекул, если газ в сосуде производит давление на стенки 5·105 Па, концентрация молекул 3·1025 м-3 и масса одной молекулы 5·10-26 кг.
Вариант 3.
1. Каков объем одного моля идеального газа при давлении 1,0 × 105 Па и температуре 27°С?
2. В сосуде объемом 0,5 находится газ под давлением 400 кПа. Какой объем будет занимать этот газ при давлении 250 кПа? Температура газа постоянна.
3. Газ массой 24 г при температуре 112 °C и давлении 2 МПа занимает объем 1,2 л. Определите молярную массу газа.
Вариант 4.
1. Кислород массой 10 г находится под давлением 3,0 × 105 Па, занимая объем 10 л. Найдите температуру газа. Молярная масса кислорода 32∙10-3 кг/моль.
2.Газ находится в баллоне при температуре 250 К и давлении 8∙Па. Определить давление газа в баллоне при температуре 350 К?
3. До какой температуры необходимо нагреть воздух, взятый при 27°С, чтобы его объем удвоился? Давление воздуха остается постоянным.
Вариант 5.
1. Газ массой 24 г при температуре 112 °C и давлении 2 МПа занимает объем 1,2 л. Определите молярную массу газа.
2. Газ находится в цилиндре с подвижным поршнем и при температуре 300 К занимает объем 250 см3. Какой объем (в см3) займет газ, если температура понизится до 270 К? Давление постоянно.
3. Какова средняя кинетическая энергия поступательного движения атома гелия при температуре 27°С?
Вариант 6.
1. Определите массу водорода, находящегося в баллоне емкостью 0,06 м3 под давлением 8,3 × 105 Па при температуре 27 °С. Молярная масса водорода 2∙10-3 кг/моль.
2. В сосуде объемом 1,2 находится газ под давлением 4* Па. Какой объем будет занимать этот газ при давлении 2* Па? Температура газа постоянна.
3. Определить давление идеального газа при температуре 3 К. Принять концентрацию молекул газа равной 1025 м-3.
Вариант 7
1. Как изменится абсолютная температура идеального газа при уменьшении его объема в 2 раза и увеличении давления в 3 раза?
2. Сколько гелия потребуется для наполнения воздушного шара емкостью 200 м3 при давлении 100кПа и температуре 27о С?
3. Газ нагрет от 27°С до 277° С при постоянном давлении. В результате его объем увеличился на 3 л. Определить первоначальный объем газа.
Вариант 8.
1. Газ, занимающий объем 1,0 л, изобарно расширяется до 3,0 л, и температура газа становится равной 157 ºС. Какой была начальная температура газа?
2. Водород массой 10 г находится под давлением 2,0 × 105 Па, занимая объем 5 л. Найдите температуру газа. Молярная масса водорода 2∙10-3 кг/моль.
3. Сколько гелия потребуется для наполнения воздушного шара емкостью 500 м3 при давлении 100 кПа и температуре 27о С?
Вариант 9.
1. Найдите среднюю кинетическую энергию молекулы одноатомного газа при давлении 20 кПа. Концентрация молекул этого газа при указанном давлении 3,0·1025 м -3.
2. Определите давление газа, занимавшего объем 0,25 л, если при давлении газа 0,95·10 5 Па его объем был равен 0,23 л. Процесс считайте изотермическим.
3. В колбе объемом 2,6 л находится кислород при давлении 230 кПаи температуре 26 оС. Сколько молей кислорода содержится в колбе?
Вариант 10.
1. Какова средняя кинетическая энергия поступательного движения атома аргона при температуре 17°С?
2. Газ, занимающий объем 2,0 л, изобарно расширяется до 3,0 л, и температура газа становится равной 147 ºС. Какой была начальная температура газа?
3. Вычислить молекулярную массу бензола, зная, что масса 0,6 л его паров при 87°C и давлении 83,2 кПа равна 1,3 г.
Вариант 11.
1. Вычислите давление одного моль газа при температуре 300 К, если его объем равен 4,15 м3.
2. При изотермическом сжатии газа его давление увеличилось с 4,0 кПа до 10 кПа, а объем уменьшился на 2,0 л. Определите начальный объем газа.
3. Сколько водорода потребуется для наполнения воздушного шара емкостью 500 м3 при давлении 100кПа и температуре 17о С?
Вариант 12 .
1. Определите массу кислорода, находящегося в баллоне емкостью 0,03 м3 под давлением 8,3 × 105 Па при температуре 27 °С. Молярная масса водорода 32∙10-3 кг/моль.
2. В сосуде объемом 2,4 находится газ под давлением 4* Па. Какой объем будет занимать этот газ при давлении 8* Па? Температура газа постоянна.
3. До какой температуры необходимо нагреть воздух, взятый при 27°С, чтобы его объем утроился? Давление воздуха все время остается постоянным.
Вариант 13.
1. Газ, занимающий объем 1,5 л, изобарно расширяется до 3,0 л, и температура газа становится равной 57 ºС. Какой была начальная температура газа?
2. Водород массой 20 г находится под давлением 200 кПа, занимая объем 8 л. Найдите температуру газа. Молярная масса водорода 2∙10-3 кг/моль.
3. Вычислить молекулярную массу бензола, зная, что масса 0,6 л его паров при 87°C и давлении 83,2 кПа равна 1,3 г.
Вариант 14.
1. Газ, занимающий объем 2,5 л, изобарно расширяется до 5,0 л, и температура газа становится равной 157 ºС. Какой была начальная температура газа?
2. В сосуде объемом 2 находится газ под давлением 400 кПа. Какой объем будет занимать этот газ при давлении 200 кПа? Процесс изотермический.
3. Определить давление идеального газа при температуре 300 К. Принять концентрацию молекул газа равной 1025 м-3.
Вариант 15.
1. Какова средняя кинетическая энергия поступательного движения атома аргона при температуре 127°С?
2. Определите массу водорода, находящегося в баллоне емкостью 0,1 м3 под давлением 8 × 105 Па при температуре 20 °С. Молярная масса водорода 2∙10-3 кг/моль.
3. Определите давление газа, занимавшего объем 0,5 л, если при давлении газа 0,75·10 5 Па его объем был равен 0,2 л. Процесс считайте изотермическим.
Источник
1. Воздушный шар объемом 2500 м3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. До какой минимальной температуры нужно нагреть воздух в шаре, чтобы шар взлетел вместе с грузом (корзиной и воздухоплавателем) массой 200 кг? Температура окружающего воздуха 7°С, его плотность 1,2 кг/м3. Оболочку шара считать нерастяжимой. (Решение)
2. Воздушный шар объемом 2500 м3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Рассчитайте максимальную массу груза, который может поднять шар, если воздух в нем нагреть до температуры 77°С. Температура окружающего воздуха 7°С, его плотность 1,2 кг/м3. Оболочку шара считать нерастяжимой. (Решение)
3.
Воздушный шар объемом 2500 м3 имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Если температура окружающего воздуха 7°С, а его плотность 1,2 кг/м3, то при нагревании воздуха в шаре до температуры 77°С шар поднимает груз с максимальной массой 200 кг. Какова масса оболочки шара? Оболочку шара считать нерастяжимой. (Решение)
4.
Воздушный шар имеет газонепроницаемую оболочку массой 400 кг и содержит 100 кг гелия. Какой груз он может удерживать в воздухе на высоте, где температура воздуха 17°С, а давление 105 Па? Считать, что оболочка шара не оказывает сопротивления изменению объема шара. (Решение)
5.
Воздушный шар с газонепроницаемой оболочкой массой 400 кг заполнен гелием. Он может удерживать в воздухе на высоте, где температура воздуха 17°С, а давление 105 Па, груз массой 225 кг. Какова масса гелия в оболочке шара? Считать, что оболочка шара не оказывает сопротивления изменению объема шара. (Решение)
 6. При исследовании уравнения состояния газа ученик соединил сосуд (1) объемом 150 мл с манометром (2) тонкой трубкой и опустил сосуд в горячую воду (см. рисунок). Чему равна плотность воздуха в сосуде? Начальные показания манометра равны 0 мм рт. ст. Шкала манометра и нижняя шкала барометра (3) проградуированы в мм рт. ст. Верхняя шкала барометра проградуирована в кПа. Объем измерительного механизма манометра и соединительной трубки значительно меньше 150 мл. (Решение)
6. При исследовании уравнения состояния газа ученик соединил сосуд (1) объемом 150 мл с манометром (2) тонкой трубкой и опустил сосуд в горячую воду (см. рисунок). Чему равна плотность воздуха в сосуде? Начальные показания манометра равны 0 мм рт. ст. Шкала манометра и нижняя шкала барометра (3) проградуированы в мм рт. ст. Верхняя шкала барометра проградуирована в кПа. Объем измерительного механизма манометра и соединительной трубки значительно меньше 150 мл. (Решение)
7. Теплоизолированный сосуд объемом V = 2 м3 разделен пористой неподвижной перегородкой на две равные части. Атомы гелия могут свободно проникать через поры в перегородке, а атомы аргона — нет. В начальный момент в одной части сосуда находится νHe = 2 моль гелия, а в другой — νAr = 1 моль аргона. Температура гелия TНe = 300 К, а температура аргона ТAr = 600 К. Определите температуру гелия после установления равновесия в системе. (Решение)
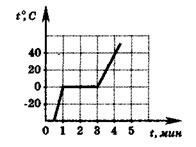 8. На рисунке представлен график изменения температуры вещества в калориметре с течением времени. Теплоемкостью калориметра и тепловыми потерями можно пренебречь и считать, что подводимая к сосуду мощность постоянна. Рассчитайте удельную теплоемкость вещества в жидком состоянии. Удельная теплота плавления вещества равна 100 кДж/кг. В начальный момент времени вещество находилось в твердом состоянии. (Решение)
8. На рисунке представлен график изменения температуры вещества в калориметре с течением времени. Теплоемкостью калориметра и тепловыми потерями можно пренебречь и считать, что подводимая к сосуду мощность постоянна. Рассчитайте удельную теплоемкость вещества в жидком состоянии. Удельная теплота плавления вещества равна 100 кДж/кг. В начальный момент времени вещество находилось в твердом состоянии. (Решение)
9. В цилиндрическом сосуде под поршнем длительное время находятся вода
и ее пар. Поршень начинают вдвигать в сосуд. При этом температура
воды и пара остается неизменной. Как будет меняться при этом масса
пара в сосуде? Ответ поясните.
(Решение)
10. В цилиндрическом сосуде под поршнем длительное время находятся вода
и ее пар. Поршень начинают вдвигать в сосуд. При этом температура
воды и пара остается неизменной. Как будет меняться при этом
отношение массы пара к массе жидкости в сосуде? Ответ поясните. (Решение)
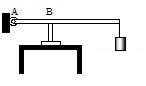 11. В цилиндр объемом 0,5 м3 насосом закачивается воздух со скоростью 0,002 кг/с. В верхнем торце цилиндра есть отверстие, закрытое предохранительным клапаном. Клапан удерживается в закрытом состоянии стержнем, который может свободно поворачиваться вокруг оси в точке А (см. рисунок). К свободному концу стержня подвешен груз массой 2 кг. Клапан открывается через 580 с работы насоса, если в начальный момент времени давление воздуха в цилиндре было равно атмосферному. Площадь закрытого клапаном отверстия 5·10-4 м2, расстояние АВ равно 0,1 м. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите длину стержня, если его можно считать невесомым.
11. В цилиндр объемом 0,5 м3 насосом закачивается воздух со скоростью 0,002 кг/с. В верхнем торце цилиндра есть отверстие, закрытое предохранительным клапаном. Клапан удерживается в закрытом состоянии стержнем, который может свободно поворачиваться вокруг оси в точке А (см. рисунок). К свободному концу стержня подвешен груз массой 2 кг. Клапан открывается через 580 с работы насоса, если в начальный момент времени давление воздуха в цилиндре было равно атмосферному. Площадь закрытого клапаном отверстия 5·10-4 м2, расстояние АВ равно 0,1 м. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите длину стержня, если его можно считать невесомым.
(Решение)
12. В цилиндр объемом 0,5 м3 насосом закачивается воздух со скоростью 0,002 кг/с. В верхнем торце цилиндра есть отверстие, закрытое предохранительным клапаном. Клапан удерживается в закрытом состоянии стержнем, который может свободно поворачиваться вокруг оси в точке А (см. рисунок к зад. 11). К свободному концу стержня подвешен груз массой 2 кг. Клапан открывается через 580 с работы насоса, если в начальный момент времени давление воздуха в цилиндре было равно атмосферному. Площадь закрытого клапаном отверстия 5·10-4 м2, расстояние АВ равно 0,1 м. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите длину AB. (Решение)
13. Воздушный шар имеет газонепроницаемую оболочку массой 400 кг и содержит 100 кг гелия. Какой груз он может удерживать в воздухе на высоте, где температура воздуха 17°С, а давление 105 Па? Считать, что оболочка шара не оказывает сопротивления изменению объема шара.
(Решение)
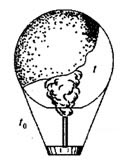
14. Воздушный шар, оболочка которого имеет массу М = 145 кг и объем V = 230 м3, наполняется горячим воздухом при нормальном атмосферном давлении и температуре окружающего воздуха t0 = 0°C. Какую минимальную температуру t должен иметь воздух внутри оболочки, чтобы шар начал подниматься? Оболочка шара нерастяжима и имеет в нижней части небольшое отверстие.
(Решение)
15. В высоком вертикальном цилиндрическом сосуде под тяжелым поршнем, способным перемещаться вдоль стенок сосуда практически без трения, находится некоторое количество воздуха под давлением p = 1,5 атм. Поршень находится в равновесии на высоте H1 = 20 см над дном сосуда. Определите, на какое расстояние ΔH сместится поршень, если сосуд перевернуть открытым концом вниз и дождаться установления равновесия. Считать температуру воздуха и атмосферное давление p0 = 1 атм постоянными. Массой воздуха в сосуде по сравнению с массой поршня можно пренебречь.
(Решение)
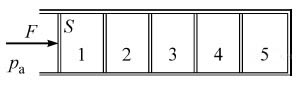 16. Горизонтальный хорошо теплопроводящий цилиндр, разделённый подвижными поршнями площадью S = 100 см2 на 5 отсеков (№№ 1—5), содержит в них одинаковые количества идеального газа при температуре окружающей среды и под давлениями, равными давлению pа = 105 Па окружающей цилиндр атмосферы (см. рисунок). Каждый поршень сдвигается с места, если приложенная к нему горизонтальная сила превышает силу сухого трения Fтр = 2 Н. К самому левому поршню прикладывают горизонтальную силу F, медленно увеличивая её по модулю. Какого значения достигнет F, когда объём газа в самом правом, 5-м отсеке цилиндра уменьшится в n = 2 раза? Процессы изменения состояния газов в отсеках цилиндра считать изотермическими.
16. Горизонтальный хорошо теплопроводящий цилиндр, разделённый подвижными поршнями площадью S = 100 см2 на 5 отсеков (№№ 1—5), содержит в них одинаковые количества идеального газа при температуре окружающей среды и под давлениями, равными давлению pа = 105 Па окружающей цилиндр атмосферы (см. рисунок). Каждый поршень сдвигается с места, если приложенная к нему горизонтальная сила превышает силу сухого трения Fтр = 2 Н. К самому левому поршню прикладывают горизонтальную силу F, медленно увеличивая её по модулю. Какого значения достигнет F, когда объём газа в самом правом, 5-м отсеке цилиндра уменьшится в n = 2 раза? Процессы изменения состояния газов в отсеках цилиндра считать изотермическими.
(Решение)
17. Горизонтальный хорошо теплопроводящий цилиндр, разделённый подвижными поршнями площадью S = 50 см2 на 5 отсеков (№№ 1—5), содержит в них одинаковые количества идеального газа при температуре окружающей среды и под давлениями, равными давлению pа = 105 Па окружающей цилиндр атмосферы (см. рисунок к зад 16). Каждый поршень сдвигается с места, если приложенная к нему горизонтальная сила превышает силу сухого трения Fтр = 4 Н. К самому левому поршню прикладывают горизонтальную силу F, медленно увеличивая её по модулю. Когда давление газа в самом правом, пятом отсеке цилиндра, увеличится в n = 3 раза? Процессы изменения состояния газов в отсеках цилиндра считать изотермическими.
(Решение)
18. Газ в цилиндрическом сосуде разделен на две равные части подвижным поршнем, имеющим массу m и площадь сечения S. При горизонтальном положении цилиндра давление газа в каждой половине сосуда равно p. Определить давление p1 газа над поршнем при вертикальном положении цилиндра. Температуру газа считать постоянной.
(Решение)
19. Сферическую оболочку воздушного шара делают из материала, квадратный метр которого имеет массу 1 кг. Шар наполняют гелием при атмосферном давлении 105 Па. Определите минимальную массу оболочки, при которой шар начнет поднимать сам себя. Температура гелия и окружающего воздуха одинакова и равна 0°С. (Площадь сферы S= 4πr2, объем шара V = 4/3πr3.)
(Решение)
20. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Площадь поперечного сечения поршня S = 30 см2. Давление окружающего воздуха p = 105 Па. Трение между поршнем и стенками сосуда пренебрежимо мало. Какое количество теплоты нужно отвести от газа при его медленном охлаждении, чтобы поршень передвинулся на расстояние х = 10 см?
(Решение)
21. В горизонтальном цилиндрическом сосуде, закрытом подвижным поршнем, находится одноатомный идеальный газ. Давление окружающего воздуха р = 105 Па. Трение между поршнем и стенками сосуда пренебрежимо мало. В процессе медленного охлаждения от газа отведено количество теплоты |Q| = 75 Дж. При этом поршень передвинулся на расстояние х = 10 см. Чему равна площадь поперечного сечения поршня?
(Решение)
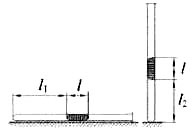 22. В запаянной с одного конца длинной горизонтальной стеклянной трубке постоянного сечения (см. рисунок) находится столбик воздуха длиной l1 = 30,7 см, запертый столбиком ртути. Если трубку поставить вертикально отверстием вверх, то длина воздушного столбика под ртутью будет равна l2 = 23.8 см. Какова длина ртутного столбика? Атмосферное давление 747 мм рт. ст.
22. В запаянной с одного конца длинной горизонтальной стеклянной трубке постоянного сечения (см. рисунок) находится столбик воздуха длиной l1 = 30,7 см, запертый столбиком ртути. Если трубку поставить вертикально отверстием вверх, то длина воздушного столбика под ртутью будет равна l2 = 23.8 см. Какова длина ртутного столбика? Атмосферное давление 747 мм рт. ст.
(Решение)
23. В водонепроницаемым мешок, лежащий на дне моря на глубине 73,1 м. закачивается сверху воздух. Вода вытесняется из мешка через нижнее отверстие, и. когда объём воздуха в мешке достигает 28,0 м, мешок всплывает вместе с прикреплённым к нему грузом массой 25,0 тонн. Определите массу воздуха в мешке в момент начала его всплывания. Температура воды раина 7°С. атмосферное давление па уровне моря равно 105 Па. Объёмом груза и стенок мешка пренебречь. Масса оболочки мешка неизвестна.
(Решение)
24. Сосуд разделен тонкой перегородкой на две части, отношение объёмов у которых V2/V1 = 3. В первой и второй частях сосуда находится воздух с относительной влажностью соответственно φ1 = 60% и φ2 = 70%. Какой будет влажность воздуха в сосуде, если перегородку убрать? Считать, что температура воздуха постоянна.(Решение)
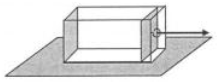 25. В металлическом сосуде под поршнем находится воздух при атмосферном давлении (см. рисунок). Сосуд имеет массу 10 кг и расположен в горизонтальном положении на поверхности стола. Поршень может скользить без трения со стенками сосуда. Массон поршня и воздуха, заключённого в сосуде, можно пренебречь. За привязанный к нему шнур поршень очень медленно тянут в горизонтальном направлении. На сколько процентов возрастёт объём воздуха под поршнем к моменту, когда сосуд начнёт скользить по столу? Коэффициент трения покоя между сосудом и поверхностью стола равен 0,5. Площадь дна поршня 105 см2. Атмосферное давление 105 Па.
25. В металлическом сосуде под поршнем находится воздух при атмосферном давлении (см. рисунок). Сосуд имеет массу 10 кг и расположен в горизонтальном положении на поверхности стола. Поршень может скользить без трения со стенками сосуда. Массон поршня и воздуха, заключённого в сосуде, можно пренебречь. За привязанный к нему шнур поршень очень медленно тянут в горизонтальном направлении. На сколько процентов возрастёт объём воздуха под поршнем к моменту, когда сосуд начнёт скользить по столу? Коэффициент трения покоя между сосудом и поверхностью стола равен 0,5. Площадь дна поршня 105 см2. Атмосферное давление 105 Па.
(Решение)
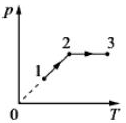 26.Один моль одноатомного идеального газа совершает процесс 1-2-3, график которого показан на рисунке в координатах р-Т. Известно, что давление газа р в процессе 1-2 увеличилось в 2 раза. Какое количество теплоты было сообщено газу в процессе 1-2-3, если его температура Т в состоянии 1 равна 300 К, а в состоянии 3 равна 900 К?
26.Один моль одноатомного идеального газа совершает процесс 1-2-3, график которого показан на рисунке в координатах р-Т. Известно, что давление газа р в процессе 1-2 увеличилось в 2 раза. Какое количество теплоты было сообщено газу в процессе 1-2-3, если его температура Т в состоянии 1 равна 300 К, а в состоянии 3 равна 900 К?
(Решение)
27. Теплоизолированный цилиндр разделён подвижным теплопроводящим поршнем на две части. В одной части цилиндра находится гелий, а в другой – аргон. В начальный момент температура гелия равна 300 К,. а аргона – 900 К. Объёмы, занимаемые газами, одинаковы, а поршень находится в равновесии. Во сколько раз изменится объём, занимаемый гелием, после установления теплового равновесия, если поршень перемешается без трения? Теплоёмкостью цилиндра н поршня пренебречь.
(Решение)
Источник
