В сосуде объемом 2 литра находится углекислый газ
30. Молекулярная физика (расчетная задача)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
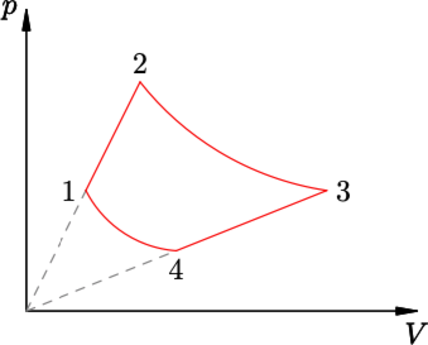
На диаграмме зависимости давления (p) от объёма (V) для некоторой массы идеального газа две изотермы пересекаются двумя изохорами в точках 1, 2, 3 и 4 (см. рисунок). Найти отношение давлений (p_3/p_1) в точках 3 и 1, если отношение температур в этих точках (T_3/T_1 = beta). Давления газа в точках 2 и 4 равны. 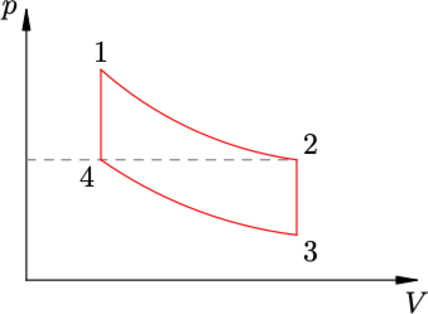
Запишем уравнения изотерм (Закон Бойля–Мариотта) [p_4V_4=p_3V_3 hspace{3 mm}p_1V_1=p_2V_2] Преобразуем с учетом, что на графике есть изотермы и (p_2=p_4) [p_1V_1=p_2V_3 hspace{3 mm}p_2V_1=p_3V_3 Rightarrow p_2=dfrac{p_1V_1}{V_3}=dfrac{p_3V_3}{V_1} Rightarrow dfrac{p_3}{p_1}=left(dfrac{V_1}{V_3}right)^2quad (1)] Отношение температур, можно выразить через уравнение Клапейрона–Менделеева [pV=nu R T Rightarrow T =dfrac{pV}{nu R} Rightarrowdfrac{T_3}{T_1}=dfrac{p_3V_3}{p_1V_1}quad (2)] Объединим (1) и (2) [left(dfrac{V_1}{V_3}right)^2dfrac{V_3}{V_1}=beta Rightarrowdfrac{V_1}{V_3}=beta Rightarrow dfrac{V_3}{V_1}=dfrac{1}{beta}] Теперь используем (2) [dfrac{p_3}{p_1}dfrac{1}{beta }=beta Rightarrow dfrac{p_3}{p_1}=beta^2]
Ответ: _β_²
Диаграмма зависимости давления (p) от объёма (V) для некоторой массы идеального газа состоит из двух изотерм и двух отрезков прямых, проходящих через начало координат (см. рисунок). Найти объём газа (V_4) в состоянии 4, если известны его объёмы (V_1), (V_2) и (V_3) в состояниях 1, 2 и 3 соответственно. 
Прямая, проходящая через начало координат описывается уравнением [p(V)=kV,] где (k) – угол наклона прямой.
Пусть объем при переходе из 4 в 3 возрастает в (alpha) раз, тогда давление в точке 2 станет равно [p(alpha V_4)=alpha k V_4=alpha p_4] Аналогично доказывается для прямой, проходящей через точки 1 и 2. Пусть при переходе из 1 в 2 давление и объем возрастает в (beta) раз. Тогда для процессов 1 – 4 и 2 – 3 можно записать [p_2V_2=p_3V_3 hspace{5 mm} p_1V_1=p_4V_4 Rightarrow beta^2 p_1V_1=alpha^2 p_4V_4 hspace{5 mm} p_1V_1=p_4V_4 Rightarrow beta=alpha] Запишем уравнение изотермы для 1–4 и выразим искомую величину [p_1V_1=p_4V_4 Rightarrow V_4 =V_1 dfrac{p_1}{p_4}] Аналогично запишем для 2–3 [p_2V_2=p_3V_3 Rightarrow alpha p_1V_2 = alpha p_4 V_3 Rightarrow dfrac{p_1}{p_4}=dfrac{V_3}{V_2}] Объединяем последние два уравнения [V_4=dfrac{V_1V_3}{V_2}]
Ответ: $$dfrac{V_1V_3}{V_2}$$
В двух сосудах объемами (V) находились углекислый газ и азот, их плотности составляли (rho_1) = 44(cdot) 10(^{-3}) кг/м(^3) и (rho_2) = 56(cdot) 10(^{-3}) кг/м(^3), затем их слили в сосуд объемом (V). Найдите установивишееся давление в сосуде, если температура в нем (T) = 300 К.
Запишем уравнение Клапейрона–Менделеева: [pV=nu R T,] где (p) — давление газа, (V) — объем газа, (nu) — количество вещества газа, (R) — универсальная газовая постоянная, (T) — температура газа в Кельвинах.
Количество вещества можно найти по формуле: [nu=dfrac{m}{mu}, ; ; ; ; (1)] где (m) — масса газа, (mu) — молярная масса газа.
Выразим давление из уравнения Клапейрона–Менделеева: [p=dfrac{nu R T}{V},; ; ; ; (2)] По закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов: [p=p_1+p_2, ; ; ; ; (3)] где (p_1) и (p_2) — давления углекислого газа и азота соответственно, (p) — общее давление смеси.
Подстваим (1), (2) в (3) с учетом того, что объемы газов и их температуры равны (так как находятся в одном сосуде): [p=dfrac{m_1 R T}{mu_1 V}+dfrac{m_2 R T}{mu_2 V}] Так как (dfrac{m}{V}) это плотность, то суммарное давление смеси: [displaystyle p=dfrac{rho_1 R T}{mu_1 }+dfrac{rho_2 R T}{mu_2 }=RTleft(dfrac{rho_1}{mu_1}+dfrac{rho_2}{mu_2} right)] Найдем общее давление смеси: [p=8,31 text{ Дж/(моль$cdot$ К)}cdot 300 text{ К}cdot left(dfrac{56cdot 10^{-3} text { кг/м$^3$} }{28cdot 10^{-3}text{ кг/моль}}+dfrac{44cdot 10^{-3} text { кг/м$^3$} }{44cdot 10^{-3}text{ кг/моль}}right)=7479text{ Па}]
Ответ: 7479 Па
Объём 0,1 литра водорода нагревают при постоянном давлении от 300 до 3000 К. При высоких температурах молекулы водорода распадаются на отдельные атомы. На графике показана зависимость доли распавшихся молекул от температуры. Чему равен конечный объём газа? Ответ дайте в литрах. 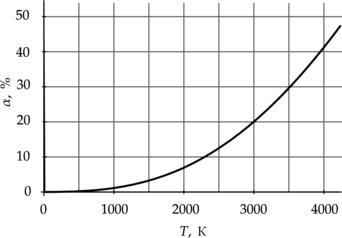
“Основная волна 2020 Вариант 4”
Запишем уравнение Клапейрона–Мендлеева для первоначального и конечного состояний: [pV_1=nu_1RT_1] [pV_2=nu_2RT_2] где (nu) – количества вещества, (T) – температура, (V) – объем.
В данном процессе молекулярый водород (2 атома) распадается а атомарный (1 атом), при этом распадается 20% от начального количества (alpha =dfrac{1}{5}) при этом из одной молекулы образуется 2 атома водорода, то есть всего образовалось (2alpha nu_1), тогда количество нераспавшихся молекул равно ((1-alpha)nu_1), откуда количества вещества в конечном состоянии: [nu_2=2alphanu_1+(1-alpha)nu_1=(1+alpha)nu_1 quad (1)] Найдем из первых двух уравнений отношение объемов с учетом (1) [dfrac{V_2}{V_1}=dfrac{(1+alpha)nu_1T_2}{nu_1T_1}Rightarrow V_2= 1,2cdot 0,1text{ л}dfrac{3000text{ К}}{300text{ К}}=1,2text{ л}]
Ответ: 1,2
Источник
Изобарный процесс
Заполните пропуск в тексте.
Повторите определение изобарного процесса.
Процесс изменения состояния термодинамической системы данной массы при называют изобарным.
постоянном давлении
постоянной температуре
постоянном объёме
Газовые законы
Заполните таблицу.
Повторите газовые законы.
| Закон | Изопроцесс | Формула |
|---|---|---|
$frac{V}{T}=const$ | ||
Изотермический | ||
Шарля |
Изохорный
Гей-Люссака
$pV=const$
Бойля–Мариотта
Изобарный
$frac{p}{T}=const$
Физические величины
Установите соответствие между физическими величинами и их единицами измерения.
Вспомните основные величины и единицы их измерения.
Уравнение состояния идеального газа
Соедините попарно физическую величину с её значением так, чтобы получились верные ответы.
1. В баллоне объёмом 2 $м^3$ находится 2 кг молекулярного кислорода при давлении $10^5$ Па. Какова температура кислорода (ответ в К)?
2. В баллоне ёмкостью 10 л находится углекислый газ при температуре 17 $^circ$ С под давлением 107 Па. Какой объём займёт этот газ при нормальных условиях (ответ в $м^3$)?
3. В закрытом сосуде объёмом 10 литров находится 2 моль азота. Температура газа равна 27 $^circ$ С. Чему равно давление газа (ответ в кПа)?
Повторите уравнение состояния идеального газа.
Изопроцессы
Соедините попарно фигуры так, чтобы каждому изопроцессу соответствовала формула.
Вспомните определения изопроцессов.
Основные величины МКТ
Решите кроссворд.
Вспомните основные величины МКТ и единицы их измерения.
Физические термины
Выделите мышкой 5 слов, которые относятся к теме урока.
1. Состояние вещества, в котором расстояние между атомами и молекулами в среднем во много раз больше размеров самих молекул.
2. Мельчайшая частица вещества.
3. Итальянский учёный XIX века, в честь которого названа постоянная, показывающая, какое количество атомов или молекул содержится в 1 моле вещества.
4. Синоним слова «корпускула».
5. Единица измерения количества вещества в СИ.
Повторите авторов законов и определения.
Газовые законы
Заполните пропуски в тексте, выбрав правильные варианты ответа из выпадающего меню.
Повторите газовые законы.
В сосуде под поршнем находится газ. При его изотермическом расширении давление газа на стенки сосуда
, температура
, объём газа
.
Измерительные приборы
Установите соответствие между физическими величинами и приборами для их измерения.
Повторите определения давления, температуры.
Экспериментальные исследования
Выберите верные утверждения, которые соответствуют результатам проведённых экспериментальных исследований.
В сосуде неизменного объема при комнатной температуре находилась смесь водорода и гелия, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль водорода. Газы считаются идеальными, а их температура постоянной.
Вспомните закон Гей-Люссака, закон Дальтона, определение парциального давления.
Парциальное давление водорода уменьшилось
Концентрация гелия увеличилась
В начале опыта концентрации газов были одинаковые
Давление смеси газов в сосуде не изменилось
В начале опыта массы газов были одинаковые
Изотермический процесс
На рисунке приведены графики двух изотермических процессов, проводимых с одной и той же массой газа. На основании графиков выберите верные утверждения о процессах, происходящих с газом.

Вспомните график изотермического процесса, на графике посмотрите направление стрелки.
Оба процесса идут при одной и той же температуре
Процесс 2 идёт при более высокой температуре
Процесс 1 идёт при более высокой температуре
Никаких выводов по графику сделать нельзя
В процессе 1 объём увеличивается
Газовые законы
Выделите мышкой 5 слов, которые относятся к теме урока.
1. Один из учёных, открывших изотермический процесс.
2. Единица измерения абсолютной температуры.
3. Параметр состояния газа постоянный в изохорном процессе.
4. Процессы, происходящие при постоянном значении одного из макропараметров состояния
5. Параметр состояния газа постоянный в изотермическом процессе.
Вспомните газовые законы.
Изопроцессы
Выделите мышкой 4 слова, которые относятся к теме урока.
1. Макроскопический параметр постоянный во всех изопроцессах.
2. Величины, характеризующие состояние газа.
3. График изопроцесса с постоянным объёмом.
4. График изопроцесса с постоянным давлением.
Вспомните изопроцессы.
Газовые законы
Выделите мышкой 4 слова, которые относятся к теме урока.
1. То, из чего состоит молекула.
2. Масса моля вещества.
3. Упрощённая модель реального газа.
4. Учёный, открывший взаимосвязь между давлением и температурой при постоянном объёме.
Повторите конспекты.
Источник
В данной работе предлагается определенный подход к классификации и способам решения задач на газовые законы. Такой подход позволит быстро сориентироваться в большом количестве задач на свойства газов и применить к ним те или иные приемы решения.
Основные теоретические сведения
Состояние газа характеризуется совокупностью трех физических величин или термодинамических параметров:объемом газа V, давлением Р и температурой Т. Состояние газа, при котором эти параметры остаются постоянными считают равновесным состоянием.В этом состоянии параметры газа связаны между собой уравнением состояния. Самый простой вид уравнение состояния имеет для идеального газа. Идеальным газом называют газ, молекулы которого не имеют размеров (материальные точки) и взаимодействуют друг с другом лишь при абсолютно упругих соударениях (отсутствует межмолекулярное притяжение и отталкивание). Реальные газы тем точнее подчиняются законам идеальных газов, чем меньше размеры их молекул (т.е. газ одноатомный), и чем больше он разряжен.
Уравнение состояния идеального газа или уравнение Менделеева-Клапейрона имеет вид:
– универсальная газовая постоянная
Из этого закона вытекает, что для двух произвольных состояний газа справедливо равенство, называемое уравнением Клапейрона:
Так же для идеальных газов имеют место следующие экспериментальные законы:
Закон Бойля — Мариотта:
Закон Гей-Люссака:
Закон Шарля:
Если в сосуде находится смесь нескольких газов, не вступающих друг с другом в химические реакции, то результирующее давление определяется по закону Дальтона: давление смеси равно сумме давлений, производимых каждым газом в отдельности, как если бы он один занимал весь сосуд.
Р = Р1 + Р2 +… + РN
Задачи, решение которых основывается на данных уравнениях, можно разделить на две группы:
§ задачи на применение уравнения Менделеева-Клапейрона.
- задачи на газовые законы.
ЗАДАЧИ НА ПРИМЕНЕНИЕ УРАВНЕНИЯ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА.
Уравнение Менделеева-Клапейрона применяют тогда, когда
I. дано только одно состояние газа изадана масса газа (или вместо массы используют количество вещества или плотность газа).
II. масса газа не задана, но она меняется, то есть утечка газа или накачка.
При решении задач на применение равнения состояния идеального газа надо помнить:
1.если дана смесь газов, то уравнение Менделеева-Клапейрона записывают для каждого компонента в отдельности.Связь между парциальными давлениями газов, входящих в смесь и результирующим давлением смеси, устанавливается законом Дальтона.
2.если газ меняет свои термодинамические параметры или массу, уравнение Менделеева-Клапейрона записывают для каждого состояния газа в отдельности и полученную систему уравнений решают относительно искомой величины.
P.S.
§ Необходимо пользоваться только абсолютной температурой и сразу же переводить значения температуры по шкале Цельсия в значения по шкале Кельвина.
§ В задачах, где рассматривается движение сосуда с газом (пузырька воздуха, воздушного шара) к уравнению газового состояния добавляют уравнения механики.
§ если между газами происходит реакция, то надо составить уравнение реакции и определить продукты реакции
ПЕРВЫЙ ТИП ЗАДАЧ: НЕТ ИЗМЕНЕНИЯ МАССЫ
Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
| V = 1 м3 μ = 0,032кг/моль m = 0,2 кг t=27 °С | Т=300К | Записываем уравнение Менделеева-Клапейрона и находим из него давление, производимое газом: |
| Р-? |
Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
| V = 12 л μ =0,044кг/моль Т=300К Р =1 МПа | 0,012м3 1∙106Па | Записываем уравнение Менделеева-Клапейрона и находим массу газа |
| m -? |
При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
| V = 12 л Т=309К Р =0,7 МПа ρ = 12 кг/м3 | 0,012м3 0,7∙106Па | Записываем уравнение Менделеева-Клапейрона Так как масса газа может быть определена через плотность газа и его объем имеем: |
| μ -? | ||
Отсюда находим молярную массу газа: | ||
Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
| V = 12 л t=20°C Р =105 Па μ =0,002кг/моль | 0,012м3 T=293К | Нормальное атмосферное давление – это давление, равное 105 Па. И эту информацию запишем как данные задачи. Записываем уравнение Менделеева-Клапейрона |
| ρ -? | ||
Так как масса газа может быть определена через плотность газа и его объем имеем: Отсюда находим плотность газа: | ||
До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении ,но при температуре Т2 = 200 К?
| Т2=200К ρ1 = ρ2 μ1 =0,032кг/моль μ2 =0,002кг/моль | Записываем уравнение Менделеева-Клапейрона для кислорода и для водорода через плотности газов: Так как по условию давление у двух газов одинаковое, то можно приравнять правые части данных уравнений: Сократим на R и на плотность ρ (по условию плотности газов равны) и найдем Т1 |
| Т1 -? | |
В сосуде объемом 4·10-3 м3 находится 0,012 кг газа при температуре 177°С. При какой температуре плотность этого газа будет равна 6·10-6 кг /см3, если давление газа остается неизменным.
Смесь газов
В баллоне объемом 25 литров находится 20г азота и 2 г гелия при 301К. Найдите давление в баллоне.
Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
Сосуд емкостью 2V разделен пополам полупроницаемой перегородкой. В одной половине находится водород массой mВ и азот массой mА. В другой половине вакуум. Во время процесса поддерживается постоянная температура Т. Через перегородку может диффундировать только водород. Какое давление установиться в обеих частях сосуда?
| μа m1 = m2 = m3 = m μв μк Т | отсек №1 отсек №2 отсек №3 Диффундирует только водород. Следовательно, после завершения установочных процессов, в отсеке I будет водород, массой на |
| РI-? РII-? | |
половину меньшей, чем была, и весь азот. А во втором отсеке только половина массы водорода. Тогда для первого отсека установившееся давление равно: Для отсека II можно так же определить установившееся давление: | |
Вакуумированный сосуд разделен перегородками на три равных отсека, каждый объемом V. В средний отсек ввели одинаковые массы кислорода, азота и водорода. В результате чего давление в этом отсеке стало равно Р. Перегородка I проницаема только для молекул водорода, перегородка II проницаема для молекул всех газов. Найти давления Р1 Р2 и Р3, установившиеся в каждом отсеке, если температура газа поддерживается постоянной и равной Т.
| μа m1 = m2 = m3 = m μв μк Р | отсек №1 отсек №2 отсек №3 После диффундирования газов через перегородки в первом отсеке окажется треть массы водорода. Во втором и в третьем отсеках будет треть водорода, половина массы кислорода и половина всей массы азота. Тогда для первого отсека установившееся давление равно: |
| Р1-? Р2-? Р3-? | |
Если до диффундирования первоначальное давление во втором отсеке было Р, то можно записать: Отсюда можно найти Находим выражение для давления во втором и в третьем отсеках | |
И тогда давление в первом отсеке равно: | |
С химическими реакциями
В сосуде находится смесь азота и водорода. При температуре Т, когда азот полностью диссоциирован на атомы, давление равно Р (диссоциацией водорода можно пренебречь). При температуре 2Т, когда оба газа полностью диссоциированы, давление в сосуде 3Р. Каково отношение масс азота и водорода в смеси?
| μа μв Т1 =Т Т2 =2Т Р1=Р Р2=3Р | mв μвmа При температуре Т параметры газов в сосуде следующие: И результирующее давление в сосуде по закону Дальтона равно: |
2Т 2Т При температуре 2Т параметры газов в сосуде следующие: И результирующее давление в сосуде по закону Дальтона равно: | |
В герметично закрытом сосуде находится 1 моль неона и 2 моля водорода. При температуре Т1=300К, когда весь водород молекулярный, атмосферное давление в сосуде Р1=105 Па. При температуре Т2=3000К давление возросло до Р2=1,5∙105 Па. Какая часть молекул водорода диссоциировала на атомы?
| ν1=1 моль ν2=2 моль Т1 =300К Т2 =3000К Р1=105 Па Р2=1,5∙105 Па | При температуре Т1 давление газа в сосуде складывается из парциальных давлений двух газов и равно: При температуре Т2 давление газа равно: |
Из уравнения (1): Из первого находим объем V: | |
В закрытом баллоне находится смесь из m1= 0,50 г водорода и m2 = 8,0 г кислорода при давлении Р1= 2,35∙105 Па. Между газами происходит реакция с образованием водяного пара. Какое давление Р установится в баллоне после охлаждения до первоначальной температуры? Конденсации пара не происходит.
| V = 25 л μ1 = 2г/моль m1 = 0,5 г μ2 = 32г/моль m2 = 8 г | В сосуде будет происходить реакция водорода с кислородом с образованием воды:
|
| Р-? | Из уравнения реакции видно, что если в реакцию вступит весь водород, то кислорода только половина |
В результате образуется ν3=0,25 молей водяного пара и останется ν4= 0,125молей кислорода. По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений Так как известно, что до реакции давление в сосуде было Р1, то для этого момента можно так же применить закон Дальтона: Решаем полученные уравнение в системе относительно неизвестного: Дата добавления: 2018-04-04; просмотров: 2814; | |
Источник
