В закрытом сосуде объемом 30 л при 20 градусах
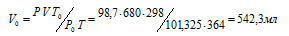
Добрый день наш уважаемый читатель. Получая часто вопросы от наших клиентов в 90% процентов из всех случаев, мы даем быстрые, четкие и грамотные ответы нашему собеседнику. Дело в том, что нашего богатого опыта работа отлично хватает чтобы закрыть потребности среднестатистического клиента или спикера.
Развернуто и не очень мы уже отвечали в нашем блоге людям на следующие вопросы:
Поставленная задача
Сейчас перед нами встала следующая задача вот такого содержания: есть сосуд с неизменяемым объемом жидкости внутри него. Предположим, что сосуд состоит из обыкновенного железа, например, возьмем простой накопительный бойлер (V = 50 литров). Начальное давление в системе 2 атмосферы, начальная температура воды Т1 = 17 градусов цельсия, конечная температура после нагрева Т2 = 57 градусов цельсия. Исходные параметры могут быть разные, но конечная задача, на которую нужно получить ответ будет следующая: какое давление будет в закрытом сосуде при нагреве воды до указанной температуры Т2, если учесть, что краны на сосуде (вход и выход) находятся в положении закрыто, и начальный объем не изменяется??? Давление можно снимать (измерять) при помощи встроенного или выносного трубного манометра. Расширительного бака нет. Все для эксперимента.
Остаемся на связи в любой момент! Компания Монтажник работает для Вас!
Закон и формула Шарля
Начав решать эту задачу, каждый может прибегнуть к такому ответу: «да ладно, это же задачка за 7 класс, тут нужно применять формулу известного физика Шарля, Вы что учебник физики не читали?». Далее следует решение:
Формула: (273+t2)/(273+t1)=коэффициент увеличения давления от исходного.
(273+57)/(273+17)=330/290=1.13.
1.13 умножаем на 2 получаем что давление будет равно 2.26 после нагрева жидкости с 17 до 57 на 40 единиц.
Ну дела, вот же решение, зачем страдать дальше? Но нет друзья, это решение конечно же хорошее – но применимо только для изохорных идеальных газов, но не в коем случае не для жидкости, представленной у нас на примере воды.
Едем дальше изучая попутно других известных святил физики, и воуля мы натыкаемся на еще одно решение.
Для расчетов берем исходные данные из чего изготовлен сосуд, у нас это железо. Коэффициент объёмного расширения железа стабильно одинаковый, берем за основу среднее значение 0,000036, а вот коэффициент объема воды изменяется в зависимости от ее нагрева. Примерно 0,00015 при 20 градусах цельсия и 0,00045 при 60 градусах цельсия. Среднее значение путем сложения из двух данных получаем 0,00030.
Чтобы посчитать объем во сколько увеличиться объем в сосуде воспользуемся формулой: 1 + коэффициент расширения железа * (t2-t1).
В цифрах будет выглядеть так: 1 + 0,000036 * (57 – 17) = 1.002;
В качестве информационной нагрузки узнаем еще на сколько бы увеличился V воды если бы она была вне сосуда: 1 + 0,0003 * (57 – 17) = 1,012. Далее все упирается на сколько же прочный Ваш сосуд и не раздует ли его при повышении давления.
Чтобы узнать процентное увеличение объема воды с воздействием на сосуд воспользуемся следующей формулой подставим все цифры: 1,012 / 1,002 * 100 – 100 = 1 %.
Обратившись к учебнику физики, мы узнаем, что при давлении каждой атмосферы объем воды уменьшается на 0,000006. Например, 50 литров, при одной атмосфере сожмется на 0,001 и будет 49.999. Зато по сравнению с газами сжимаемость жидкостей действительно ничтожна: в десятки тысяч раз меньше.
Если объём воды при 2 атм = 50 литров, то при 500 атм объём станет примерно на 1 литр меньше. (разница в двух числах 2%).
1%/2% * 500 = 250 атмосфер, то значение при котором по идее должно разорвать Ваш бак и то давление которое будет у вас при нагреве. Честно, считаем это какой-то бред и не он никак не сочетается с реальными жизненными показателями, полученными в ходе эксперимента.
Изучав дальше интернет и опираясь на наши знания всех из коллег нашего отдела было перепробовано масса различных вариантов и изучено мнений других людей, которые потом можно было бы использоваться для выявления формулы по нашей задаче:
Вода при нагревании увеличивается в объеме до 4%, т.е. 50 наших литров должны превратиться в 52 литра за счет ее расширения, но применить данную теорию в нашем вопросе нам пока не удалось. Мы даже изучили соотношение плотности льда к плотности воды и поняли объем в этом случае увеличивается на 11 процентов.
Есть мнение (алгоритм) с нашей стороны что ни одну из формул применить тут нельзя, так как в баке или бойлере представленным нами невозможно заполнить его на все 100% жидкостью, какую часть в одной жидкости все равно будет составлять воздух, который в этом случае будет работать как расширительный бак и возможно поэтому те 800 атмосфер которые получаются у разных людей нормализуются тем количеством воздуха который содержаться в сосуде.
Если Вы физик или технически подкованный человек, разбираетесь в данном вопросе и готовы разрешить наш спор и получить ответ на поставленную задачу – ждем Ваших решений под этой записью в комментариях.
Со своей стороны хотим так же сказать, что при проведении реального эксперимента и нагрева воды в бойлере с 18-20 градусов до 50, давление поднялось по манометру с 1.5 очков (бар, атмосфер) примерно и до 5 бар.
Спасибо за проявленный труд, терпение и прочтение данной статьи. Надеемся что этот вопрос решится в ближайшее время и мы найдем грамотный ответ.
Всего Вам доброго и приятного дня.
Другие полезные записи в блоге – только для Вас!
- Котел КСУВ наружного размещения. Почему он является лучшим из всех? Технические особенности, выбор большинства организаций. Котельная больше не нужна. Устанавливай прямо со зданием.
- История на “миллион”, как мы помогли ДОЛ “Лесное озеро”. Крупный DIY проект России, сделай сам!
- Тепловой пункт: какой промышленный котел выбрать?
- Наглядный ремонт КЧМ руками наших специалистов.
- ОАО “Кировский завод” банкрот. Какая судьба ожидает котлы КЧМ-5, КЧМ-5К, КЧМ-7 Гном?
- Почему в котлах КЧМ-5К не используются колосники? Техническая информация и не только.
- Все основные запасные части к котлу КЧМ, артикулы, описание и много полезной информации.
- Лемакс – лучшее соотношение цена/качество в бытовых котлах.
- 1000 колосников на складе компании МОНТАЖНИК – новый завоз.
- Что такое колосник? Расскажем все очень подробно.
- Почему котлы ИШМА покупают 90 из 100 клиентов. Лучшее соотношение цены-качества.
- Лучший конкурент котла Buderus, Valliant, Protherm – это Кентатсу (Kentatsu) – или как мы его называем один в поле ВОИН! А так же там мы ответили на вопрос, что лучше русский КЧМ или Турецкояпонский гигант?
- Полная подробная инструкция по монтажу промышленных котлов
- Посмотреть все статьи и новости
Наши отправки (отгрузки), услуги и выполненные работы:
Статьи посвященные нашим отгрузкам не только поднимают наш авторитет как считаем мы, но они направлены на увеличение доверия со стороны потенциальных клиентов. Нам нечего скрывать – мы делимся с Вами своими продажами и успехами. У нас нет скрытых продаж и ухода от налогов. Мы стараемся делать наше с Вами сотрудничество и работу максимально прозрачными. Мы хотим чтобы Вы доверяли нашей команде!
Если у Вас есть идеи о том, о том что Вы бы хотели увидеть на нашем канале. То присылайте их на нашу легкую почту: 426909@bk.ru. Если Вам понравилась статья оцените ее, поставьте палец вверх слева экрана (если Вы читаете ее с компьютера), а также подпишитесь на наш блог, Вас ждет много полезной и интересной информации.
С вами на связи была компания ООО “Монтажник” – официальный дистрибьютор нескольких заводов изготовителей по всей стране. По вопросам приобретения котлов, насосов и другого сопутствующего оборудования (запчасти, дымоходы, автоматика) можете обращаться по телефонам: 8(47354) 2-55-25; 2-69-09 или на электронную почту: 426909@bk.ru или montagnikvrn@yandex.ru.
Наш логотип
Отзывы о нашей компании:
15 лет на рынке – ни одного плохого отзыва за все время работы.
Посмотреть все отзывы.
СПАСИБО ЧТО ОСТАЕТЕСЬ С НАМИ! Рассказывайте друзьям, делитесь материалом со своими знакомыми. Нам важен каждый.
Компания которая относится к своему клиенту с ДУШОЙ!
Заказ через наш интернет магазин
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:
Обозначив искомое давление газа через Р2, можно записать:
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:
По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:
где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
Для удобства пользователей и возможности быстрого нахождения решения типовых (и не очень) расчётных задач на газовые законы.
©Для некоммерческого использования. При перепечатке решений обязательна ссылка на источник.
Всем успеха!
уравнение Менделеева-Клапейрона p·V = nRT = (m/M)·R·T
R = 0,0821 л∙атм/(моль∙К) = 8,314 Дж/(моль∙К)
[Дж/(моль∙К)] = [м³∙Па/(моль∙К)] = [л∙кПа/(моль∙К)]
T(K) = T(ºС)+273
Для n=соnst: pV/T=соnst, отсюда:
Для изобарического (изобарного) процесса (Р= const): V1/Т1 = V2/Т2
Для изохорического (изохорного) процесса (V= const): P1/Т1 = P2/Т2
Закон Шарля: для изотермического процесса (T= const): P1V1 = P2V2
При изотермическом процессе (ΔТ=0) для идеального газа, расширяющегося обратимо (т.е. для простой системы) Q = А , ΔH=ΔU = Q – A = 0 (или Δu =СvΔТ=0, Δh=СpΔТ=0)
Работа изотермического расширения системы: А (Дж) = nRT ∙ ln (V2 /V1) = nRT ∙ ln (р1/р2)
Таблица перевода единиц измерения давления: https://www.dpva.info/Guide/GuideUnitsAlphabets/GuideU..
https://fluitech.com.ua/ru/tech-info/tech-info-2.html
Онлайн перевод единиц давления:
https://www.convert-me.com/ru/convert/pressure/
https://www.unitjuggler.com/перевод-pressure-из-Pa-в-b..
https://www.edinici.ru/Perevodchik-Davleniya/Kalkulyat..
https://www.rusactive.ru/useful/converter/pressure и т.д.
Общее давление газовой смеси является суммой парциальных давлений её компонентов.
1-й закон Рауля: парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе.
Закон Авогадро: равные количества газов, находящихся в одинаковых условиях, занимают одинаковый объем: V1 : V2 : V3 … = n1 : n2 : n3…
Отредактировал администратор, 30 июн 2019 в 15:42.
Задача 1
Какова температура газа, если его давление составляет 30 атм, масса 1,5 кг, объем 170 л, плотность по воздуху 1,08?
Решение:
р (газа) = 30 атм = 3039,75 кПа
m (газа) = 1,5 кг = 1500 г
Mr (газа) = d · Mr(воздуха) = 1.08 · 29 = 31,3 г/моль
По уравнению Менделеева-Клапейрона p·V = (m/M)·R·T
отсюда:
T = p · V · M / (m · R) = 3039,75 · 170 · 31,3 / (1500 · 8,314) = 1300 K
Задача 2
Колбу емкостью 232 мл заполнили некоторым газом при температуре 17 градусов и давлении 752 мм рт.ст. Масса колбы увеличилась на 0,27 г. Вычислить молярную массу газа.
Решение:
Уравнение Менделеева-Клапейрона: PV = mRT / M, отсюда:
M = mRT /PV = 0,27 г • 0,082 л·атм/моль·К • 290К/ (0,232 л • 752/760 атм) = 28 г/моль
Например, азот N2.
Задача 3
Какой объем водорода необходимо затратить для восстановления 250г MoO3, при температуре 27 С и нормальном давлении?
Решение:
1) написать уравнение реакции: MoO3 + 3Н2 → Mo + 3Н2О
2) найти моли водорода n:
На восстановление 1 моль MoO3 нужны 3 моль Н2
Найти моли MoO3 по формуле n = m/M и умножить на 3
3) посчитать объем v по формуле
pv=nRT, р-давление (нормальное – 1 атм), R – универс. газовая постоянная, T – темп. в К (Т°C + 273),
или
3) посчитать объем при н.у. (0°C) и пересчитать для 27°C, по формуле: V1:V2 = T1:T2 , где T – темп. в К.
Задача 4
Какой объем водяного пара получается от взрыва смеси 100 мл водорода и 100 мл кислорода при 100 С?
Решение:
По закону Авогадро, при одинаковых условиях отношение объемов газов в реакции равно отношению молей газов в реакции, (т.е. коэффициентов в уравнении реакции).
2Н2 + О2 → 2Н2О
По уравнению реакции, 2 моль водорода реагируют с 1 моль кислорода (отношение 2:1), поэтому для реакции со 100 мл водорода нужны только 50 мл кислорода (а остальные 50 мл останутся в избытке).
Из уравнения также следует, что из 2 моль водорода получатся 2 моль водяного пара (отношение 1:1), поэтому из 100 мл водорода получит 100 мл водяного пара.
Задача 5
В баллоне емкостью 12 литров при температуре равной 0 градусов Цельсия находится 100 гр. кислорода. Определите давление в баллоне.
Решение:
PV=nRT
V=12 L
n=m/M=100/32=… mol
R=0,082
T=273 K
P=nRT/V=… кПа
Задача 6
250 мл водорода собраны над водой при 26 градусах и давлении 98,6 кПа, давление насыщенного пара воды при 26 градусах составляет 3,4 кПа. Вычислить объем водорода при нормальных условиях и его массу.
Решение:
Давление, создаваемое водородом:
Р(Н2)= 98,7 – 3,4 = 95,3 кПа.
По объединенному газовому закону можно найти объем Н2 при н.у.:
PV/T = P1V1/T1
P,V,T – давление, объем и температура при н.у.,
P1,V1,T1 – давление, объем и температура при данных условиях.
Температура должна быть в градусах Кельвина, а объем в литрах.
При н.у. Р= 1 атм = 103,32 кПа, Т=0°C = 273К
V= P1∙V1∙T/T1∙P = 95,3 ∙ 0,25 ∙ 273 / [(26 + 273) ∙ 103,32] = 0,211 л
n = V/Vm = 0,211/22,4 = … моль
m = n∙M = … г
Задача 7
Сосуд вместимостью 0.5 л выдерживает давление до 500 атм. Тротил разлагается по уравнению:
2C6H2CH3(NO2)3 → 3N2 + 12CO + 5H2 + 2C
Температура внутри сосуда после взрыва достигает 2000(цельсия). Вычислите максимальную массу тротила, взрыв которой не должен разрушить сосуд.
Решение:
Т=2000 + 273=2273К
Р=500 атм.
V=0,5 л
PV=nRT
R = 0,0821 л∙ат/моль∙град
n=PV/RT=500∙0,5/(0,0821∙2273)=1,34 моль газа
2C6H2CH3(NO2)3 →3N2 (г)+12CO (г)+5H2 (г) +2C (т)
Из 2 моль тротила образуются 3+12+5=20 моль газа,
тогда 1,34 моль газа образуются из 1,34∙2/20=0,134 моль тротила.
М(тротила) = 227 г/моль
m=n∙М=0,134 ∙ 227 = 30,4 г
Задачка из книги Сергея Дмитриевича Бескова “Техно-химические расчеты” аж 1962 г., еще я ее решала в далекой институтской молодости, до сих пор в шкафу 🙂 У него, правда, ответ 32,1 т.к. вопрос был несколько другим: “Какое наименьшее количество тротила может разорвать сосуд”.
Задача 8
При действии натрия на воду выделился водород, который при 20 °С и 94 кПа занял объем 10 л. Какая масса натрия прореагировала с водой?
Решение:
P = 94 кПа, T = 293 K , V = 10 л
По уравнению Менделеева-Клапейрона PV = nRT
отсюда:
n(Н2) = PV/RT = 94 ∙ 10 / (8,314 ∙ 293) = 0,39 моль
Из уравнения реакции: 2Na + 2H2O → 2NaOH + H2↑
n(Na) = 2n(Н2) = 0,78 моль
m(Na) = n∙M = 0,78 ∙ 23 = 17,9 г
Задача 9
При н. у. объем газа равен 100 м3. До какой температуры нужно нагреть этот газ, чтобы при 9,852 ∙ 104 Па объем его стал равен 122 м3?
Решение:
P1∙V1/T1 = P2∙V2/T2
T2 = T1∙P2∙V2/P1∙V1
При н.у. Р=10,1325 ∙ 10^4 Па, T=273,15 К
T2 = 273,15 ∙ 9,852 ∙ 10^4 ∙ 122 / (10,1325 ∙ 10^4 ∙100) = 324К = 51°С
Задача 10
В баллоне емкостью 12 л. при температуре равной 0 градусов находится 100 гр. кислорода. Определите давление в баллоне.
Решение:
По уравнению Менделеева-Клапейрона:
PV=nRT = mRT/M → P=mRT/MV
m=100 г
М=32 г/моль
Т=273 К
R=8,314
V=12 л
P=100 ∙ 8,314 ∙ 273 / (32 ∙ 12) = 591 кПа
Задача 11
Определите молекулярную массу газа и его плотность при 25 градусов, если 3,5 г его при 0 градусов и давления 25310 Па занимают объем 11200 см3.
Решение:
PV=mRT/M
M=mRT/PV=3,5 ∙ 8,314 ∙ 273/(25,310 ∙ 11,2)=28 г/моль
V1/Т1 = V2/Т2
V2 = V1 ∙ Т2 / Т1 = 11200 ∙ 298 / 273 = 12226 см3
ρ = m/V = 3,5 / 12226 = 2,86 ∙ 10^–4 г/см3
Задача 12
В баллоне емкостью 30 л находится 0,55 кг гелия под давлением 76000 мм. рт. ст. Рассчитать его температуру.
Решение:
Формула выглядит следующим образом: p•Vm = R•T, где p — это давление (атм), Vm — молярный объем газа (л/моль), R — это универсальная газовая постоянная (0,082) , а Т — абсолютная температура идеального газа (К).
Tаким образом: Т = (p•Vm)/R
Если не известен молярный объем газа, мы можем найти его по формуле: Vm = V/n, где n – количество вещества (найти n можно, разделив массу газа на его молярную массу: n=m/М).
Уравнение Менделеева-Клапейрона записывается именно в таком виде:
p•V = (m/М) • R • T.
Отсюда: T = (p • V • М)/(R• m)
Если давление дается в мм рт. ст., то нужно перевести его в атмосферы, исходя из соотношения: 1 атм = 760 мм рт. ст.
T = (p • V • М)/(R• m) = (100 атм • 30 л • 4 г/моль)/(0,082 • 550 г) = …К = … – 273 °C
(осталось посчитать)
Задача 13
В закрытом баллоне находится газ при температуре-10 до какой температуры нужно его нагреть, чтобы давление увеличилось на 20%.
Решение:
по закону Шарля, отношение давления к температуре остается постоянным при прочих равных условиях. Отсюда: P1/T1 = P2/T2
P2 = 1,2 P1
“-10”, полагаю, должно означать, что Т1=-10°C, т.е. 263К
Отсюда: Т2= T1 х P2 / P1 = 263 х 1,2 P1 / P1 = 263 х 1,2 =315,6К =315,6 -273 = 42,6°C
Можно быстрее: отношение давления к температуре постоянно, поэтому для увеличения давления на 20% нужно увеличить температуру на 20% (только не забыть, что температура в газовых законах всегда по шкале Кельвина, т.е. Т°C+273)
Задача 14
При какой температуре находятся 5 кг азота, имеющие объем 50 л и давление 172 мм рт. ст.?
Решение:
р (газа) = 172 мм рт. ст ∙ 0,1333 = 22,9 кПа
m (газа) = 5 кг = 5000 г
V=50 л
Mr (азота) = 28 г/моль
По уравнению Менделеева-Клапейрона p·V = (m/M)·R·T
Oтсюда:
T = p · V · M / (m · R) = 22,9 · 50 · 28 / (5000 · 8,314) = 0,77 K
Почти абсолютный ноль 🙂
Задача 15
Сколько весят при нормального условиях (р=1 ат, т=273 к) 2,5 литра кислорода?
Решение:
По уравнению Менделеева-Клапейрона: PV=mRT/M => m=PVM/RT
р = 1 атм = 101,325 кПа
V = 2,5 л
R = 8,314
M=32 г/моль
T = 273 К
отсюда:
m= 101,325 x 2.5 x 32 / (8,314 x 273) = 3,57 г
Задача 16
Определите, во сколько раз увеличится объем системы при полном испарении 1 л жидкой воды при постоянной температуре 100 градусов по Цельсию и постоянном давлении 1 атм.
Решение:
Нач. объем системы V0=1 л
По уравнению Менделеева-Клапейрона, для газа:
p·V = (m/M)·R·T
V = m·R·T/M·р
m = 1000 г
М = 18 г/моль
R = 8,314
р (пара) = 1 атм = 101,325 кПа
T = 373 К
V = 1000 · 8,314 · 373 / (18 · 101,325) = 1700,3 л
V/V0 = 1700,3 – объем увеличится в 1700,3 раз
Задача 17
Вычислить массу азота, взятого объемом 100л, при давление 790 кПа и температуре 28ºС.
Решение:
pV=nRT = mRT/M
m=pVM/RT = 790 ∙ 100 ∙ 28 / (8,314 ∙ 301) = … г
Задача 18
Решение:
С5Н12 + 8О2 → 5СО2(г) + 6Н2О(г)
1…………..8………….5…………..6 – отношение кол-в в-в газов в реакции горения
По закону Арогадро, равные количества газов, находящихся в одинаковых условиях, занимают одинаковый объем.
Поэтому на сгорание 8 м3 С5Н12 требуется 8х8=64 м3 О2, при этом образуются 8х5=40 м3 СО2 и 8х6=48 м3 водяного пара, всего 88 м3 газов – продуктов горения.
О2 составляет в среднем 21%об. воздуха, и требуется избыток воздуха 140%(1,4), отсюда:
V возд. = 64 ∙ 1,4 / 0,21 = 426,7 м3
Все объемы верны для темп. 40°С.
Задача 19
а) Давление газа, занимающего при некоторой температуре объём 0,3 м³, равно 101,5 кПа. Каким будет давление, если при той же температуре увеличить объём газа до 0,5 м³?
б) При 17ºС объём газа 440 л. Какой объём займёт тот же газ при 47ºС ( Р= const)?
в) В баллоне при 20ºС находится газ под давлением 4,053 МПа (40 атм.). Каким станет давлением, если температура повышается до 30ºС?
Решение:
а) Для изотермического процесса: P1V1 = P2V2
P2=P1V1/V2 = 0,3 ∙ 101,5 / 0,5 = 60,9 кПа
б) Для Р= const: V1/Т1 = V2/Т2, T(K) = T(ºС)+273
в) Для V= const: P1/Т1 = P2/Т2, T(K) = T(ºС)+273
Источник
