В закрытом сосуде происходит реакция синтеза иодоводорода

Химическое равновесие. | ||||||
| ||||||
| ||||||
| ||||||
| ||||||
| ||||||
| ||||||
|
Источник
Задача 350.
Реакция СО + С12 ⇔ СОС12 протекает в закрытом сосуде при постоянной температуре; исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остается 50% начального количества СО. Определить давление равновесной газовой смеси, если первоначальное давление равнялось 100 кПа (750 мм рт. ст.).
Решение:
Уравнение реакции имеет вид:
СО + С12 ⇔ СОС12
По условию задачи в реакцию вступило 50% СО. Из уравнения реакции следует, что из 1 моля СО и 1 моля С12 образуется 1 моль СОС12. Следовательно, из 0,5 моль СО и 0,5 моль С12 образовалось тоже 0,5 молей СОС12. Учитывая, что вещества реагируют друг с другом в эквивалентных количествах, значит, в 1л реакционной смеси содержится 2 моля исходных веществ (СО и С12), половина из которых прореагировало с образованием 0,5 молей СОС12.
Таким образом, количество системы уменьшилось на 0,5 молей и составило после протекания реакции 1,5 молей (2 – 0,5 = 1,5). Следовательно, давление равновесной газовой смеси определится из пропорции:
2 : 1,5 = 100 : х; х = (1,5 . 100)/2 = 75 кПа.
Ответ: 75кПа.
Задача 351.
В закрытом сосуде установилось равновесие: СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.); константа равновесия равна единице. Определить: а) сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2? б) в каких объемных соотношениях были смешаны СО2 и Н2, если к моменту наступления равновесия в реакцию вступило 90% первоначального количества водорода?
Решение:
а) Уравнение реакции имеет вид
СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.)
Из уравнения следует, что из 1 моля СО2 и 1 моля Н2 образуется по 1 молю СО и Н2О.
Обозначим равновесную концентрацию СО и Н2О через х, тогда [CO] = [H2O]. Таким образом, равновесные концентрации СО2 и Н2 будут составлять, соответственно, (1 – х) и (5 – х)моль/л, а СО и Н2О – по х моль/л. Подставим эти значения в выражение константы равновесия реакции:
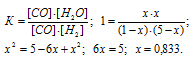
Таким образом, 83,3% СО2 подвергнется разложению в СО, учитывая, что [CO2] = 1 моль/л.
б) Находим количество Н2, которое вступило в реакцию: 5 . 0,9 = 4,5 моль/л. Остаток количества СО2 и Н2 одинаков и будет составлять 0,5 моль/л (5 – 4,5 = 0,5). Тогда объёмные соотношения СО2 и Н2, к моменту наступления равновесия, составляют:
V(H2) : V(CO2) = 4,5 : 0,5 = 9 : 1 .
Ответ: а) 83,3%; б) 9:1.
Задача 352.
При состоянии равновесия в системе:
N2(г) + 3H2(г) ⇔ 2NН3(г);  = -92,4 кДж
= -92,4 кДж
концентрации участвующих веществ равны: [N2] = 3 моль/л; [H2] = 9 моль/л; [NН3] = 4 моль/л. Определить: а) исходные концентрации Н2 и N2 б) в каком направлении сместится равновесие с ростом температуры? в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
Решение:
а) Для нахождения исходных концентраций веществ N2 и Н2 учтём, что, согласно уравнению реакции из 1 моля N2 и 3 молей Н2 образуется 2 моля NH3. Поскольку по условию задачи в каждом литре системы образовалось 4 моля NH3, то при этом было израсходовано 1/2 . 4 = 2 моля N2 и 3/4 . 4 = 6 молей Н2. Таким образом, искомые исходные концентрации N2 и Н2 равны:
[N2]0 = 3 + 2 = 5 моль/л;
[H2]0 = 6 + 3 = 9 моль/л.
б) Из уравнения реакции следует, что данная реакция экзотермическая, т.е. протекает с выделением теплоты. Поэтому при повышении температуры в экзотермической системе, согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения действия температуры, т.е. влево.
в) Реакция протекает с уменьшением числа молей газообразных веществ, т.е. с уменьшением объёма и, соответственно, с уменьшением давления в системе. Поэтому при уменьшении объёма реакционного сосуда равновесие системы сместится в сторону образования аммиака, вправо, т.е. согласно принципу Ле Шателье, в сторону уменьшения действия (повышения давления при уменьшении объёма реакционного сосуда).
Ответ: а) [N2]0 = 5 моль/л, [H2]0 = 6 + 3 = 9 моль/л; б) влево; в) вправо.
Задача 353.
Константа равновесия реакции FeO(к) + CO(г) ⇔ Fe(к) + CO2(г), при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли: [СО] = 0,05 моль/л, [СО2] = 0,01 моль/л.
Решение:
Для нахождения равновесных концентраций веществ учтем, что, согласно уравнению реакции из 1 моля СО образуется 1 моль СО2. Обозначим количество, прореагировавшего вещества СО за x моль. Учитывая, что моль СО2 образуется при реакции, то при этом равновесная концентрация СО будет равна (0,05 – х)моль/л, а СО2 – (0,01 + х) моль/л.
Таким образом, подставив в выражение константы равновесия реакции эти концентрации, найдём значение:
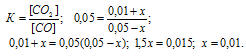
Отсюда искомые равновесные концентрации веществ равны:
[СО]равн. = 0,05 – 0,01 = 0,04 моль/л;
[СО2]равн. = 0,01 + 0,01 = 0,02 моль/л.
Ответ: [СО] = 04 моль/л; [СО2] = 0,02 моль/л.
Задача 354.
Равновесие в системе H2(г) + I2(г) ⇔ 2HI(г) установилось пи следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Решение:
Для нахождения исходных концентраций йода и водорода учтём, что согласно уравнению реакции, из 1 моля йода и 1 моля водорода образуется 2 моля йодоводорода. Поскольку по условию задачи в каждом литре системы образовалось 0,09 молей вещества HI, то при этом было затрачено 0,045 (0,09/2 = 0?045) молей H2 и, соответственно 0,045 молей I2.
Отсюда находим исходные концентрации водорода и йода:
[I2]исх. = 0,005 + 0,045 = 0.0 5моль/л;
[H2]исх. =.0,025 + 0,045 = 0,07 моль/л.
Ответ: [H2]исх. = 0,07 моль/л; [I2]исх. = 0.05 моль/л.
Задача 355.
При некоторой температуре равновесие в системе 2NO2 ⇔ 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,006 моль/л; [NO] = 0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию NO2.
Решение:
Константа равновесия данной реакции выражается уравнением:
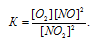
Учитывая, что равновесная концентрация О2 будет составлять 1/2 концентрации NO, т.е. 0,012 моль/л (0,024/2 = 0,012), рассчитаем константу равновесия:
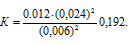
Для нахождения исходной концентрации NO2 учтём, что согласно уравнению реакции из 1 моля NO2 образуется 1 моль NO. Поскольку по условию задачи в каждом литре системы образовалось 0,024 моля NO, то при этом было израсходовано 0,024 моля NO2.
Таким образом, искомая исходная концентрация NO равна:
[NO2]исх. = 0,006 + 0,024 = 0,03 моль/л.
Ответ: К = 0,192; [NO2]исх. = 0,03 моль/л.
Источник

Евгения,
Задача 148
Степень диссоциации PCl5 при 473К и давлении 1 атм равна 0,485, а при 523К и давлении 1 атм – 0,8. Найти среднее значение теплового эффекта реакции синтеза PCl3+Cl2=PCl5 при постоянном давлении и постоянном объеме в интервале температур 473-523 К.
Решение:
α1(PCl5) = 0,485, значит в результате диссоциации 1 моль PCl5 распадаются 0,485 моль PCl5 и в системе остаются 1–0,485 = 0,515 моль PCl5 , при этом образуются по 0,485 моль PCl3 и Cl2.
Если принять объем системы за 1 л, то для реакции PCl3+Cl2⇆PCl5 константа равновесия:
К1=[PCl5]/[PCl3][Cl2] = 0,515 / 0,485²= 2,19
α2(PCl5) = 0,8, в равновесной системе находятся 1–0,8 = 0,2 моль PCl5 и по 0,8 моль PCl3 и Cl2:
К2=[PCl5]/[PCl3][Cl2] = 0,2 / 0,8² = 0,313
Kравн = k0∙е^–(ΔH/RT)
Если при пост. объеме и давлении ΔН не изменяется в данном интервале температур, то:
ΔНср. =R ∙ ln(K2/K1)/(1/Т1 – 1/Т2) = 8,314∙ ln(0,313/2,19)/(1/473 – 1/523) = – 80024 Дж/моль =
– 80,024 кДж/моль
Бэла,помогите мне пожалуйста, очень прошу!!!!
Провести расчёт Delta H, Delta S, Delta G при стандартных условиях. Охарактеризовать полученную величину данной реакции N2(г)+O2(г)->NO2(г)

Помогите пожалуйста!! Задача 1- в некоторой реакции при изменение начальной концентрации от 1 моль/л до 3 моль/л период полу превращения уменьшился с 3 часов до 20 минут . Каков порядок этой реакции и чему равна константа скорости?
помогите составить уравнения константы равновесия:
4 HCl + O2 = 2 H2O + 2 Cl2
Бэла, Выручите пожалуйста, нужно решить 2 задание на этом листочке. Затрудняюсь в его понимании

При смешении 1 моль уксусной кислоты и 1 моль этилового спирта реакция протекает по уравнению CH3COOH(г) + C2H5OH(г) = CH3COOC2H5(г) + H2O(г). При достижении равновесия в реакционной смеси находится 1/3 моль кислоты, 1/3 моль спирта, 2/3 моль эфира и 2/3 моль воды. Вычислите количество моль эфира, которое будет в реакционной смеси по достижению равновесия при следующих условиях: 1 моль кислоты, 1 моль спирта и 1 моль воды.

Денислам,
Задача 149
При смешении 1 моль уксусной кислоты и 1 моль этилового спирта реакция протекает по уравнению: CH3COOH(г) + C2H5OH(г) ⇆ CH3COOC2H5(г) + H2O(г).
При достижении равновесия в реакционной смеси находится 1/3 моль кислоты, 1/3 моль спирта, 2/3 моль эфира и 2/3 моль воды.
Вычислите количество моль эфира, которое будет в реакционной смеси по достижению равновесия при следующих условиях: 1 моль кислоты, 1 моль спирта и 1 моль воды.
Решение:
Константа гомогенного равновесия Кравн. (или Кeq)= отношение произведения концентраций продуктов к произведению концентраций реагентов:
Кравн. = [CH3COOC2H5][H2O]/[CH3COOH][C2H5OH]
В случае, если общее кол-во молей газа в реакции неизменно, отношение концентраций равно отношению молей.
Здесь из 2 моль газа образуются 2 моль газа, поэтому:
Кравн. = n(CH3COOC2H5)×n(H2O)/[n(CH3COOH)×n(C2H5OH)] = (2/3)² / (1/3)² = 4
Предположим, что температура реакционной смеси не изменилась.
Тогда константа равновесия постоянна.
Выразим n(CH3COOC2H5) через Кравн. и подставим данные второго равновесия, получим:
n(CH3COOC2H5) = Кравн. × n(CH3COOH)×n(C2H5OH) / n(H2O) = 4× 1² / 1 = 4 моль
Помогите пожалуйста!!! 
Исходные концентрации А и В в системе 2а+В=2АВ были соответственно равны 0.04 и 0.02 моль/л. К моменту наступления равновесия концентрация А стала равной 0,01 моль/л. Вычислите равновесные концентрации всех остальных реагирующих веществ.

Олеся,
Задача 150
Исходные концентрации А и В в системе 2а+В=2АВ были соответственно равны 0.04 и 0.02 моль/л. К моменту наступления равновесия концентрация А стала равной 0,01 моль/л. Вычислите равновесные концентрации всех остальных реагирующих веществ.
Решение:
уравнение реакции 2А+В=2АВ
отношение молей: 2 . . 1. . . 2
Если принять, что объем системы не изменяется в реакции, то отношение конц-й = отношению молей (кол-в вещества).
До наступления равновесия прореагировали 0,04 – 0,01 = 0,03 моль/л в-ва А.
В соотв-и с отношением кол-в веществ в реакции (2:1:2), до равновесия прореагировали 0,03/2 моль/л в-ва В и образовались 0,03 моль/л в-ва АВ.
Т.о. в состоянии равновесия система состоит из 0,03 моль/л А, 0,02 – 0,015 = 0,005 моль/л В и 0,03 моль/л АВ.
С соотношениями проблема(
Плюс ещё в молях, с концентрациями более менее понятней.
NO2 NO O2
Исход: 1 моль, 0, 0
Расход: 0,5 моль, ?, ?
Равновесие: ?, ?, ?
Вот с коэффициентами не могу понять, как быть, что за x принимать и т.д.
Мне бы просто дробь для Кс, дальше сама.
Бэла, Если прореагировало 0,5 молей NO2, то NO и O2 сколько? Стехиометрические коэффициенты на что умножать или делить?

Бэла, здравствуйте! Будет ли различие в константах химического равновесия (Кр) следующих реакций при одинаковой температуре?
1/2H2+1/2 HCl=HCl;
H2+Cl2=2HCl
3. В системе H2 (г) + I2 (г) 2HI (г) установилось равновесие при концентрациях [H2] = 0,25 моль/л, [I2] = 0,05 моль/л, [HI] = 0,9 моль/л. Определить исходные концентрации йода и водорода.
Исходные концентрации веществ в реакции О2+4НСl⇆2Н2О+2Сl2. были для
HCl и O2 равны по 1 моль/л. Каковы стали концентрации исходных и получен-ных веществ к моменту, когда концентрация HCl стала равной 0,6 моль/л (объ-ем не изменялся)?

Помогите пожалуйста. А)Запишите выражение для константы равновесия реакции:C2H2(г)+H2(г)=C2H4(г) Б)Как следует изменить давление,чтобы сдвинуть равновесие системы вправо?: CO(г)+H2O(г)=СO2(г)+H2(г) В)Константа равновесия реакции К=1: CO2+H2=CO(г)+H2O(г). Начальная концентрация СO2 и H2O равны соответственно 0,2 и 0,8 моль/л.Найдите равновесную концентрацию CO
бэла помогите мне пожалуйста, очень важно. в реакционной системе 2NO(r)+CL2(r)стрелка 2NO CL(r) установилось равновесие. скорость какой реакции(прямой или обратной) станет преобладающей при а) повышение общего давления в системе б) уменьшении концентрации паров NO CL

Помогите пожалуйста, долгое время не могу понять как решить.
В реакционный сосуд введены 1 моль Н2 и Sb2S3 и нагреты до 713 К. Константа равновесия реакции Кр=0,429. Определить,сколько молей сурьмы образуется и сколько молей водорода израсходуется по этой реакции в состоянии равновесия.
Sb2S3(тв)+3H2=2Sb(тв)+3H2S
1. Константа скорости реакции синтеза йодоводорода, протекающей по уравнению
Н2(г) + I2(г) = 2HI(г),
при некоторой температуре составила 0,16. Определите скорость этой реакции в начальный момент времени, когда концентрации реагентов были равны С0μ(Н2) = 0,04 моль/л и С0μ(I2) =0,05 моль/л, а также в момент, когда прореагирует 75% водорода. Как изменилась скорость этой реакции?
2. Определите, при какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 ч. Температурный коэффициент скорости реакции равен 3,2.
3. Реакция термического разложения этана является реакцией первого порядка. При 823 К константа скорости реакции равна 2,5•105 с-1, а при 903 К – 141,5•105 с-1. Рассчитайте энергию активации и период полупревращения (τ½) этой реакции при 873 К.
4. Разложение оксида азота (1) на поверхности золотого катализатора при высоких температурах протекает по уравнению
2N2O(г) + [Au](т) = 2N2(г) + O2(г) + [Au](т).
При начальной концентрации N2O, равной 3,2 моль/л, константа скорости этой реакции составила 5•10-4 л/моль•мин. Определите время, за которое разложится 25% исходного количества вещества.
5. Докажите, что реакция взаимодействия муравьиного альдегида и пероксида водорода с образованием муравьиной кислоты и воды является реакцией второго порядка. Известно, что через 2 ч после начала в системе осталось 50% реагентов, а через 2 ч 40 мин концентрация муравьиной кислоты снизилась до 0,215 моль/л. Начальные концентрации НСОН и Н2О2 были одинаковыми и равными 0,50 моль/л.
6. Реакция синтеза аммиака при 723 К протекает по уравнению
N2 + 3H2 <=> 2NH3.
Константа равновесия при этой температуре КР = 5,34•10-8. Определите парциальное давление аммиака, если парциальные давления азота и водорода равны соответственно 65 717 и 20 380 Па.
7. При некоторой температуре из 1 моля сульфохлорида SO2Cl2, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,5 моль вещества по уравнению
SO2Cl2 <=> SO2 + Cl2.
Определите константу равновесия этой реакции.
8. Рассчитайте изменение общего давления в гетерогенной равновесной системе
2PbS(т) + 3O2(г)<=> 2PbO(т) + 2SO2(г),
если начальная концентрация кислорода составляла 0,1 моль/л, а к моменту равновесия прореагировало 30% исходного газообразного вещества.
9. Определите, в какую сторону сместится равновесие реакции разложения
2А(г) <=> 2С(г) + D(г) + ΔН,
если увеличить давление в системе в 2 раза и одновременно понизить температуру на 300. Температурные коэффициенты прямой и обратной реакций равны соответственно 2,7 и 3,3.
10. Равновесные концентрации веществ, участвующих в реакции этерификации
СН3СООН + С2Н5ОН <=> СН3СООС2Н5 + Н2О,
равны (моль/л): Сμ(СН3СООН) = 0,02; Сμ(С2Н5ОН) = 0,32: Сμ(СН3СООС2Н5) = 0,08: Сμ(Н2О) = 0,08.
Помогите пожалуйста!!
146.
Равновесие в системе H2(г)+ I2(г) 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
129.
При увеличении температуры с 30 до 45оС скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции?
Источник
