В закрытом сосуде протекает химическая реакция
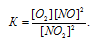
Предлагаем вашему вниманию некоторые задания-аналоги части А из ЦТ 2015 по химии. В начале страницы вы можете выполнить тест онлайн (после выбора ответа нажимайте кнопку «Проверить ответ»: если ответ неверный, то выбирайте другой ответ, пока не выберите верный, а если ответ верный, то у вас появится ссылка зелёного цвета, с помощью которой вы можете просмотреть подробное видео-объяснение этого задания, но помните, что ссылка неактивная, поэтому для просмотра видео-объяснения вам необходимо скопировать эту ссылку и вставить на новую страницу и нажать клавишу Enter, как результат у вас откроется видео на YouTube). В середине страницы вы увидите текстовые условия заданий, для которых видео-объяснения даны сразу после каждого задания, а текстовые ответы представлены в конце страницы.
1. ЦТ по химии 2015. А22. В закрытом сосуде, объём которого постоянный, протекает химическая реакция 2А + 3Б = 4В + г (все вещества находятся в газообразном состоянии). До начала реакции молярная концентрация вещества А равнялась 6 моль/дм3, а вещества В – 0 моль/дм3. Укажите время (с), которое понадобится для того, чтобы концентрации веществ А и В стали равны, если скорость образования вещества В равна 0,04 моль/дм3∙с:
1) 50
2) 75
3) 100
4) 125
2. ЦТ по химии 2015. А24. Имеется водный насыщенный раствор сульфита магния. Укажите действия (-е), которые (-ое)приведут (-ёт) к образованию осадка:
а) упаривание раствора с последующим охлаждением до первоначальной температуры;
б) разбавление раствора дистиллированной водой с параллельным повышением температуры;
в) добавление в раствор твёрдого сульфита натрия;
г) добавление в раствор твёрдого хлорида магния;
1) а, в, г
2) а, б
3) а, г
4) в
3. ЦТ по химии 2015. А25. В раствор, в котором были растворены карбонат натрия и сульфат рубидия, добавили избыток раствора серной кислоты. В результате образовался новый раствор, к которому добавили избыток раствора нитрата бария. В конечном растворе присутствуют ионы:
1) Rb+, Na+, NO3—
2) Ba2+, Rb+, Na+, NO3—
3) Ba2+, H+, Rb+, Na+, NO3—, SO42-
4) Ba2+, H+, Rb+, Na+, NO3—
4. ЦТ по химии 2015. А30.

5. ЦТ по химии 2015. А36.

Ответы:
1. 3
2. 1
3. 4
4. 2
5. 1
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
- Посмотреть все пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Источник
Задача 350.
Реакция СО + С12 ⇔ СОС12 протекает в закрытом сосуде при постоянной температуре; исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остается 50% начального количества СО. Определить давление равновесной газовой смеси, если первоначальное давление равнялось 100 кПа (750 мм рт. ст.).
Решение:
Уравнение реакции имеет вид:
СО + С12 ⇔ СОС12
По условию задачи в реакцию вступило 50% СО. Из уравнения реакции следует, что из 1 моля СО и 1 моля С12 образуется 1 моль СОС12. Следовательно, из 0,5 моль СО и 0,5 моль С12 образовалось тоже 0,5 молей СОС12. Учитывая, что вещества реагируют друг с другом в эквивалентных количествах, значит, в 1л реакционной смеси содержится 2 моля исходных веществ (СО и С12), половина из которых прореагировало с образованием 0,5 молей СОС12.
Таким образом, количество системы уменьшилось на 0,5 молей и составило после протекания реакции 1,5 молей (2 – 0,5 = 1,5). Следовательно, давление равновесной газовой смеси определится из пропорции:
2 : 1,5 = 100 : х; х = (1,5 . 100)/2 = 75 кПа.
Ответ: 75кПа.
Задача 351.
В закрытом сосуде установилось равновесие: СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.); константа равновесия равна единице. Определить: а) сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2? б) в каких объемных соотношениях были смешаны СО2 и Н2, если к моменту наступления равновесия в реакцию вступило 90% первоначального количества водорода?
Решение:
а) Уравнение реакции имеет вид
СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.)
Из уравнения следует, что из 1 моля СО2 и 1 моля Н2 образуется по 1 молю СО и Н2О.
Обозначим равновесную концентрацию СО и Н2О через х, тогда [CO] = [H2O]. Таким образом, равновесные концентрации СО2 и Н2 будут составлять, соответственно, (1 – х) и (5 – х)моль/л, а СО и Н2О – по х моль/л. Подставим эти значения в выражение константы равновесия реакции:
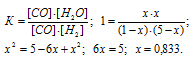
Таким образом, 83,3% СО2 подвергнется разложению в СО, учитывая, что [CO2] = 1 моль/л.
б) Находим количество Н2, которое вступило в реакцию: 5 . 0,9 = 4,5 моль/л. Остаток количества СО2 и Н2 одинаков и будет составлять 0,5 моль/л (5 – 4,5 = 0,5). Тогда объёмные соотношения СО2 и Н2, к моменту наступления равновесия, составляют:
V(H2) : V(CO2) = 4,5 : 0,5 = 9 : 1 .
Ответ: а) 83,3%; б) 9:1.
Задача 352.
При состоянии равновесия в системе:
N2(г) + 3H2(г) ⇔ 2NН3(г);  = -92,4 кДж
= -92,4 кДж
концентрации участвующих веществ равны: [N2] = 3 моль/л; [H2] = 9 моль/л; [NН3] = 4 моль/л. Определить: а) исходные концентрации Н2 и N2 б) в каком направлении сместится равновесие с ростом температуры? в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
Решение:
а) Для нахождения исходных концентраций веществ N2 и Н2 учтём, что, согласно уравнению реакции из 1 моля N2 и 3 молей Н2 образуется 2 моля NH3. Поскольку по условию задачи в каждом литре системы образовалось 4 моля NH3, то при этом было израсходовано 1/2 . 4 = 2 моля N2 и 3/4 . 4 = 6 молей Н2. Таким образом, искомые исходные концентрации N2 и Н2 равны:
[N2]0 = 3 + 2 = 5 моль/л;
[H2]0 = 6 + 3 = 9 моль/л.
б) Из уравнения реакции следует, что данная реакция экзотермическая, т.е. протекает с выделением теплоты. Поэтому при повышении температуры в экзотермической системе, согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения действия температуры, т.е. влево.
в) Реакция протекает с уменьшением числа молей газообразных веществ, т.е. с уменьшением объёма и, соответственно, с уменьшением давления в системе. Поэтому при уменьшении объёма реакционного сосуда равновесие системы сместится в сторону образования аммиака, вправо, т.е. согласно принципу Ле Шателье, в сторону уменьшения действия (повышения давления при уменьшении объёма реакционного сосуда).
Ответ: а) [N2]0 = 5 моль/л, [H2]0 = 6 + 3 = 9 моль/л; б) влево; в) вправо.
Задача 353.
Константа равновесия реакции FeO(к) + CO(г) ⇔ Fe(к) + CO2(г), при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли: [СО] = 0,05 моль/л, [СО2] = 0,01 моль/л.
Решение:
Для нахождения равновесных концентраций веществ учтем, что, согласно уравнению реакции из 1 моля СО образуется 1 моль СО2. Обозначим количество, прореагировавшего вещества СО за x моль. Учитывая, что моль СО2 образуется при реакции, то при этом равновесная концентрация СО будет равна (0,05 – х)моль/л, а СО2 – (0,01 + х) моль/л.
Таким образом, подставив в выражение константы равновесия реакции эти концентрации, найдём значение:
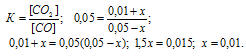
Отсюда искомые равновесные концентрации веществ равны:
[СО]равн. = 0,05 – 0,01 = 0,04 моль/л;
[СО2]равн. = 0,01 + 0,01 = 0,02 моль/л.
Ответ: [СО] = 04 моль/л; [СО2] = 0,02 моль/л.
Задача 354.
Равновесие в системе H2(г) + I2(г) ⇔ 2HI(г) установилось пи следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Решение:
Для нахождения исходных концентраций йода и водорода учтём, что согласно уравнению реакции, из 1 моля йода и 1 моля водорода образуется 2 моля йодоводорода. Поскольку по условию задачи в каждом литре системы образовалось 0,09 молей вещества HI, то при этом было затрачено 0,045 (0,09/2 = 0?045) молей H2 и, соответственно 0,045 молей I2.
Отсюда находим исходные концентрации водорода и йода:
[I2]исх. = 0,005 + 0,045 = 0.0 5моль/л;
[H2]исх. =.0,025 + 0,045 = 0,07 моль/л.
Ответ: [H2]исх. = 0,07 моль/л; [I2]исх. = 0.05 моль/л.
Задача 355.
При некоторой температуре равновесие в системе 2NO2 ⇔ 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,006 моль/л; [NO] = 0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию NO2.
Решение:
Константа равновесия данной реакции выражается уравнением:
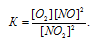
Учитывая, что равновесная концентрация О2 будет составлять 1/2 концентрации NO, т.е. 0,012 моль/л (0,024/2 = 0,012), рассчитаем константу равновесия:
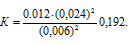
Для нахождения исходной концентрации NO2 учтём, что согласно уравнению реакции из 1 моля NO2 образуется 1 моль NO. Поскольку по условию задачи в каждом литре системы образовалось 0,024 моля NO, то при этом было израсходовано 0,024 моля NO2.
Таким образом, искомая исходная концентрация NO равна:
[NO2]исх. = 0,006 + 0,024 = 0,03 моль/л.
Ответ: К = 0,192; [NO2]исх. = 0,03 моль/л.
Источник
1
Задание 23 № 423
В сосуде объемом 5 дм3 протекает реакция Через 5 с после начала реакции образовалось вещество химическим количеством 10 моль. Средняя скорость (моль/дм3 · с) образования вещества равна:
1) 0,42) 23) 14) 0,25
2
Задание 21 № 471
В замкнутой системе протекает реакция между газообразными веществами
Укажите все факторы, увеличивающие скорость прямой реакции:
а — повышение давления в системе
б — понижение температуры
в — уменьшение концентрации вещества
г — уменьшение объема системы
1) а, г2) а, в, г3) б, в4) а, б, в, г
3
Задание 22 № 472
О протекании химических процессов в водном растворе свидетельствует:
1) увеличение растворимости азота при повышении давления2) усиление окраски раствора при увеличении концентрации в бромной воде3) выделение теплоты при растворении в воде4) выпадение кристаллов при охлаждении его насыщенного раствора
4
Задание 21 № 521
В закрытой системе протекает одностадийное превращение
После установления равновесия давление в системе увеличили в четыре раза.
Укажите правильное утверждение:
1) равновесие в системе НЕ нарушилось2) скорость обратной реакции уменьшилась3) увеличилась скорость и прямой, и обратной реакции4) увеличился объем системы
5
Задание 22 № 572
В закрытом сосуде протекает химическая реакция A + 2B = 2C + D. До начала реакции молярная концентрация вещества А равнялась 3 моль/дм3, а вещества C — 0 моль/дм3. Через сколько секунд концентрации веществ A и C сравняются, если скорость образования вещества C составляет 0,04 моль/дм3 · с (все вещества — газы, объем сосуда постоянный)?
1) 252) 333) 504) 67
6
Задание 16 № 616
Исходные концентрации веществ C и B, участвующих в одностадийной реакции C+B=D, равны соответственно 1,5 моль/дм3 и 2,47 моль/дм3. Через минуту после начала реакции концентрация вещества C снизилась до 0,75 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества B (моль/дм3) через минуту после начала реакции равны соответственно:
1) 0,0235 и 1,622) 0,0125 и 1,723) 0,0125 и 1,254) 0,0435 и 1,65
7
Задание 23 № 773
В сосуде объемом 4 дм3 протекает реакция Через 14 с после начала реакции образовалось вещество химическим количеством 28 моль. Средняя скорость (моль/дм3 · с) образования вещества равна
1) 22) 83) 0,54) 0,25
8
Задание 23 № 823
В сосуде объемом 2 дм3 протекает реакция Через 4 с после начала реакции образовалось вещество химическим количеством 12 моль. Средняя скорость (моль/дм3 · с) образования вещества равна
1) 0,52) 1, 53) 14) 2
9
Задание 23 № 873
В сосуде объемом 2 дм3 протекает реакция Через 8 с после начала реакции образовалось вещество химическим количеством 4 моль. Средняя скорость (моль/дм3 · с) образования вещества равна
1) 0, 052) 0, 253) 14) 4
10
Задание 23 № 923
В сосуде объемом 5 дм3 протекает реакция Через 10 с после начала реакции образовалось вещество химическим количеством 20 моль. Средняя скорость (моль/дм3 · с) образования вещества равна
1) 0, 42) 23) 14) 0, 25
11
Задание 16 № 1116
Исходные концентрации веществ А и В, участвующих в одностадийной реакции А + В = С, равны соответственно 1,45 моль/дм3 и 1,56 моль/дм3. Через 50 с после начала реакции концентрация вещества А снизилась до 0,97 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества В (моль/дм3) через 50 с после начала реакции равны соответственно:
1) 0,0035 и 1,022) 0,0025 и 1,043) 0,0025 и 1,054) 0,0096 и 1,08
12
Задание 21 № 1171
В закрытой системе протекает одностадийное превращение
После установления равновесия давление в системе увеличили в три раза.
Укажите правильное утверждение:
1) скорость прямой реакции уменьшилась2) скорость обратной реакции превысила скорость прямой3) равновесие в системе НЕ нарушилось4) увеличился объем системы
13
Задание 22 № 1172
Повышение температуры от 20 °С до 80 °С приведет к увеличению растворимости в воде:
1) 2) 3) 4)
14
Задание 16 № 1216
Исходные концентрации веществ А и В, участвующих в одностадийной реакции А + В = С, равны соответственно 0,68 моль/дм3 и 1,2 моль/дм3. Через 40 с после начала реакции концентрация вещества А снизилась до 0,28 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества В (моль/дм3) через 40 с после начала реакции равны соответственно:
1) 0,01 и 0,622) 0,05 и 0,403) 0,02 и 0,604) 0,01 и 0,80
15
Задание 16 № 1316
Исходные концентрации веществ А и В, участвующих в одностадийной реакции А + В = С, равны соответственно 2,45 моль/дм3 и 1,94 моль/дм3. Через 48 с после начала реакции концентрация вещества А снизилась до 1,37 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества В (моль/дм3) через 48 с после начала реакции равны соответственно:
1) 0,0235 и 0,522) 0,0125 и 0,783) 0,0225 и 0,864) 0,0435 и 0,65
16
Задание 22 № 1372
В закрытом сосуде протекает химическая реакция А + 2В = 2С + D. До начала реакции молярная концентрация вещества В равнялась 1 моль/дм3, а вещества D — 0 моль/дм3. Через сколько секунд концентрации веществ В и D сравняются, если скорость образования вещества D составляет 0,01 моль/дм3 · с (все вещества — газы, объем сосуда постоянный)?
1) 662) 503) 334) 25
17
Задание 22 № 1422
О протекании химических процессов в водном растворе свидетельствует:
1) усиление окраски раствора при увеличении концентрации в воде2) увеличение растворимости при повышении давления3) наличие запаха у аммиачной воды4) выделение теплоты при растворении в воде
18
Задание 21 № 1471
В замкнутой системе протекает реакция между газообразными веществами
Укажите все факторы, увеличивающие скорость прямой реакции:
а — повышение давления в системе
б — уменьшение концентрации исходных веществ
в — повышение температуры
г — увеличение объема системы
1) а, г2) а, в3) б, в4) а, б, г.
19
Задание 22 № 1472
О протекании химических процессов в водном растворе свидетельствует:
1) увеличение скорости растворения при нагревании раствора2) выделение поваренной соли из раствора путем выпаривания воды3) наличие окраски у раствора брома в воде4) выделение газа при растворении калия в воде
20
Задание 21 № 1521
В замкнутой системе протекает реакция между газообразными веществами
Укажите все факторы, увеличивающие скорость прямой реакции:
а — понижение давления в системе
б — повышение температуры
в — увеличение концентрации вещества А
г — увеличение объема системы
1) б, в2) а, б, г3) в, г4) б, в, г
21
Задание 22 № 1522
О протекании химических процессов в водном растворе свидетельствует:
1) наличие запаха у раствора хлора в воде2) выделение теплоты при растворении в воде3) возможность получения чистой воды из раствора путем дистилляции4) увеличение растворимости кислорода при понижении температуры
22
Задание 21 № 1571
В замкнутой системе протекает реакция между газообразными веществами
Укажите все факторы, увеличивающие скорость прямой реакции:
а — понижение давления в системе
б — понижение температуры
в — увеличение концентрации вещества В
г — уменьшение объема системы
1) а, б2) а, в, г3) б, в4) в, г
23
Задание 22 № 1572
О протекании химических процессов в водном растворе свидетельствует:
1) увеличение скорости растворения в воде при повышении температуры2) наличие окраски у бромной воды3) выделение газа при растворении в воде4) наличие запаха у водного раствора
24
Задание 22 № 1622
В закрытом сосуде протекает химическая реакция А + 3В = 3С + D. До начала реакции молярная концентрация вещества А равнялась 1 моль/дм3, а вещества С — 0 моль/дм3. Через сколько секунд концентрации веществ А и С сравняются, если скорость образования вещества С составляет 0,03 моль/дм3 · с (все вещества — газы, объем сосуда постоянный)?
1) 252) 383) 504) 76
25
Задание 22 № 1672
В закрытом сосуде протекает химическая реакция А + 3В = 3С + D. До начала реакции молярная концентрация вещества А равнялась 3 моль/дм3, а вещества С — 0 моль/дм3. Через сколько секунд концентрации веществ А и С сравняются, если скорость образования вещества С составляет 0,03 моль/дм3 · с (все вещества — газы, объем сосуда постоянный)?
1) 252) 333) 674) 75
26
Задание 22 № 1722
В закрытом сосуде протекает химическая реакция А + 2В = 2С + D. До начала реакции молярная концентрация вещества В равнялась 1 моль/дм3, а вещества D — 0 моль/дм3. Через сколько секунд концентрации веществ В и D сравняются, если скорость образования вещества D составляет 0,04 моль/дм3 · с (все вещества — газы, объем сосуда постоянный)?
1) 82) 163) 254) 33
27
Задание 22 № 1772
Сумма коэффициентов перед веществами молекулярного строения в уравнении реакции, протекающей по схеме , равна:
1) 92) 73) 114) 14
28
Задание 22 № 1822
Сумма коэффициентов перед веществами НЕмолекулярного строения в уравнении реакции, протекающей по схеме , равна:
1) 242) 213) 94) 5
29
Задание 22 № 1872
Сумма коэффициентов перед веществами молекулярного строения в уравнении реакции, протекающей по схеме , равна:
1) 162) 123) 84) 5
30
Задание 18 № 2168
Скорость растворения цинка в соляной кислоте практически НЕ зависит от:
1) давления;2) степени измельчения цинка;3) концентрации ионов 4) температуры.
Завершить тестирование, свериться с ответами, увидеть решения.
Источник
