Влияние л карнитина на сосуды головного мозга
Оглавление:
- Спортивное питание для снижения веса и похудения
- Наборы с дисконтом
- Какие побочные эффекты возможны при использовании L-карнитина?
- Правила приёма L-карнитина: как избежать побочных эффектов?
- Противопоказания к приему Л-карнитина
- Получить промокод на скидку – 20%!
L-карнитин – это спортивная добавка к основному рациону атлета. Благодаря участию в жировом обмене и метаболических процессах позиционируется как жиросжигатель. Во время приёма l-карнитина атлет ощущает отчетливый прилив сил за счет высвобождения энергии из жировых клеток, повышается выносливость, что благотворно сказывается на показателях тренировки и постепенном сжигании жира.
Добавка выпускается в порошковой, жидкой, ампульной и таблетизированной форме (в зависимости от формы варьируется скорость усвоения продукта). Нельзя также не отметить такую новинку рынка спортивного питания, как протеиновые и энергетические батончики с добавлением l-карнитина.
Какие побочные эффекты возможны при использовании L-карнитина?
В спортивной медицине неоднократно проводились исследования воздействия L-карнитина на организм человека, тем не менее, ни в одном из них не были обнаружены явные побочные эффекты от приёма добавки.
В лабораторных условиях опытным путем было доказано, что превышение дозировки L-карнитина (даже в десятки и сотни раз) не вызывает опасных побочных действий, так что данной добавкой невозможно отравиться (естественно, злоупотреблять не стоит). Вместе с тем, существует риск индивидуальной непереносимости препарата, которой сопутствуют такие негативные последствия как рвота, тошнота, проблемы с ЖКТ, резкий запах пота и мочи, повышение артериального давления и сердцебиение.
Все эти побочные эффекты – результат индивидуальной непереносимости добавки. При их появлении (это случается крайне редко) стоит прекратить потребление препарата, и проконсультироваться с врачом касательно целесообразности дальнейшего приёма. Кроме того, эти последствия могут быть реакцией на красители и усилители вкуса в добавке (если таковые имеются).
При несоблюдении рекомендаций по употреблению Л-карнитина, возможно возникновение бессонницы. Этому есть очень простое объяснение. После приёма Л-карнитина повышается уровень энергии, требующей высвобождения, соответственно, человек чувствует себя бодрым и полным сил, что позволяет ему тренироваться более эффективно. Если добавка употребляется в первой половине дня (в это время она максимально эффективна), к вечеру эффект снижается, и спортсмен полноценно отдыхает. Если же систематично принимать Л-карнитин во второй половине дня, при этом не проводить интенсивных тренировок, то во время отхода ко сну, соответственно, спортсмена будет мучать бессонница. Последний прием Л-карнитина необходимо совершать как минимум за 4 часа до сна.
Кроме того, на фоне приёма Л-карнитина отмечается повышение аппетита. Так как Л-карнитин ускоряет метаболизм, организм быстрее тратит энергию, и истощает свои резервы. Мозг реагирует на истощение энергетических запасов чувством голода. Избавиться от чрезмерного аппетита очень просто: достаточно придерживаться корректной схемы приёма добавки и правильного питания, обогащенного белком и клетчаткой.
Правила приёма L-карнитина: как избежать побочных эффектов?
Несмотря на то, что превышение дозировки L-карнитина не влечет за собой опасных для здоровья последствий, главное правило его приёма – соблюдение дозы в 1200-2000 мг в сутки. Когда речь заходит о выступающих бодибилдерах или профессиональных спортсменах на соревновании, эта цифра может быть и выше, но все же её не стоит поднимать выше 6 г дабы организм не прекратил собственную выработку Л-карнитина.
В большинстве своём, люди мечтают похудеть и сохранить мышечную массу, не прикладывая к этому никаких усилий. Стоит помнить, что данная добавка – это вспомогательное средство, эффективное подспорье в борьбе за прекрасное тело. Без ваших усилий на тренировке хороших результатов не будет.
Во избежание проблем со сном и аппетитом, L-карнитин нужно принимать по следующей схеме:
- при высоком уровне нагрузки необходимо 2 приёма карнитина в день: 1 до первого приёма пищи, 2 за полчаса – час до тренировки (до тренировки нужно пить не менее 500-600 мг карнитина);
- при среднем уровне нагрузки и на диете, та же самая доза в 1200-2000 мг делится на 4 приёма: перед основными приёмами пищи и перед тренировкой;
- в дни отдыха потребление карнитина можно снизить до 500 мг, разделив дозу на пару приёмов до завтрака и обеда.
Иногда побочные эффекты от применения карнитина связаны с тем, что истек его срок годности, либо не были соблюдены правила хранения. Просроченный и испорченный Л-карнитин не следует употреблять. Особенности хранения товара указаны на упаковке: обычно это прохладное, темное, сухое место. Контакт с водой, солнечными лучами и избыточным теплом, портят L-карнитин, сводя на нет всю его пользу.
Противопоказания к приему Л-карнитина
- аллергия на белок, молочные и яичные продукты;
- беременность (вне зависимости от срока);
- проблемы с щитовидной железой;
- период лактации;
- нахождение на диализе;
- тяжелые болезни ЖКТ;
- уремия (в этом случае употребление л-карнитина допустима, однако превышение дозы чревато слабостью в мышцах).
Написали:
Токаев Энвер Саидович подробнее
Хасанов Адам Алиевич подробнее
Промокод “article”, введите данный промокод при оформлении заказа
в нашем интернет-магазине и получите скидку 20% на весь заказ!
Источник
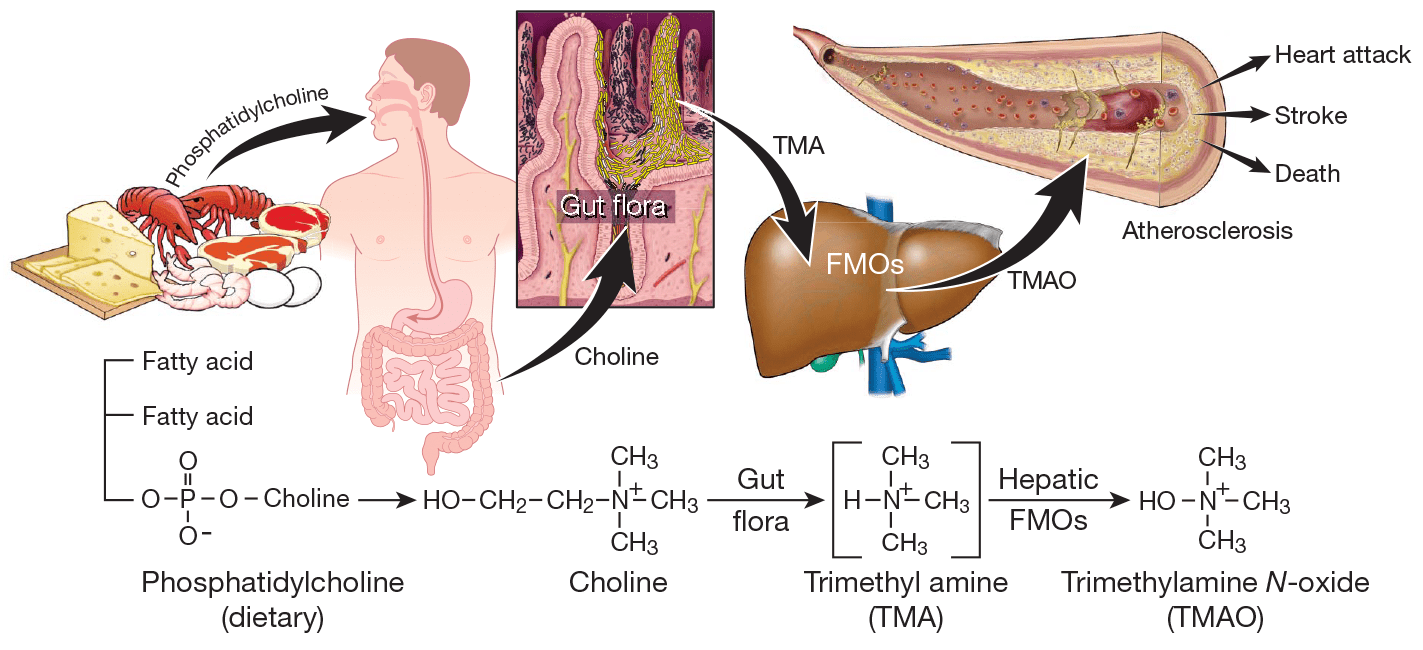
Статья на конкурс «био/мол/текст»: Обильное потребление мясных продуктов в развитых странах связывают с повышенным риском сердечнососудистых заболеваний, объясняя это высоким содержанием насыщенных жиров и холестерина в мясе. Но так ли это? Исследования 2013 года не подтвердили связи между потреблением насыщенных жиров и повышенным риском развития сердечнососудистых заболеваний [1], что подтолкнуло ученых к поиску других факторов, приводящих к патологии. Тут-то и вспомнили про еще одну особенность мясных продуктов – обильное содержание L-карнитина.
Думайте, что покупаете!
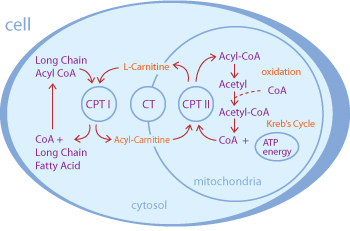
Рисунок 1. Участие L-карнитина в транспорте жирных кислот из цитоплазмы в митохондрию для β-окисления и получения энергии. CPT – карнитин-пальмитоилтрансфераза, CT – карнитин-ацилкарнитинтранслоказа, CoA – кофермент A.
Впервые L-карнитин был выделен двумя русскими учеными в 1905 году. Следовательно, сейчас идет уже второй век с момента открытия и начала изучения роли этой молекулы в организме человека [2]. Это один и самых исследуемых компонентов пищи. Пища, а именно красное мясо – основной источник карнитина у всеядных животных; тем не менее, немного L-карнитина синтезируется из лизина и в самом организме.
Кроме того, все больше и больше людей потребляет L-карнитин в качестве пищевых добавок. Помимо интернет-магазинов, магазинов спортивного питания и аптек, карнитин стал встречаться даже на полках продуктовых магазинов нашей страны, в том числе и в составе витаминов, энергетических напитков, шоколадных батончиков и прочего. Купить L-карнитин или продукты с его содержанием может кто угодно. В большинстве случаев L-карнитин принимают, видимо, в надежде интенсифицировать разрушение жиров, так как считается, что он осуществляет транспорт жирных кислот в митохондриальный матрикс, где происходит их разрушение с выделением энергии (рис. 1).
Реклама L-карнитина обещает быстрое похудение, увеличение мышечной массы, улучшение умственной и физической формы, устойчивости к стрессу, детоксикацию организма и многое другое. Надо сказать, что многие положительные эффекты карнитина действительно научно доказаны, но не стоит забывать о том, что до сих пор неизвестно, вреден ли избыток карнитина для здоровья.
Норма потребления L-карнитина для взрослого человека составляет 300 мг, тогда как для похудения и улучшения спортивных показателей оптимальными считаются дозы от 500 мг до 2 г в сутки. В надежде же обрести идеальное тело, прилагая при этом минимум усилий, люди в несколько раз превышают норму, не задумываясь о возможных последствиях. А зря. Ведь мы знаем, что метаболические пути в организме недостаточно изучены, и что практически все лекарства – да что там, даже витамины при их чрезмерном употреблении – имеют побочные действия. И L-карнитин не является исключением! Исследования 2013 года показали, что метаболит L-карнитина – триметиламин оксид (ТМАО) – вещество, способствующее развитию атеросклероза [3].
Задуматься о возможной связи L-карнитина с развитием атеросклероза заставило открытие 2011 года, показавшее связь метаболизма холина – структурного аналога L-карнитина – с патогенезом сердечнососудистых заболеваний [3]. Главным источником холина служит фосфатидилхолин – одна из самых распространенных молекул клеточных мембран, в больших количествах содержащаяся пище животного происхождения.
Как оказалось, холин используется некоторыми кишечными бактериями для синтеза интермедиата триметиламина (ТМА) (рис. 2). В свою очередь, ТМА быстро абсорбируется и окисляется ферментами семейства FMO (флавинмонооксигеназа, FMO3 – главный фермент процесса) в печени до ТМАО, вызывающего развитие атеросклероза.

Рисунок 2. Схема синтеза кишечной флорой метаболита фосфатидилхолина, стимулирующего развитие атеросклероза. Фосфатидилхолин служит источником холина, который некоторые бактерии кишечника способны использовать для синтеза ТМА. ТМА, в свою очередь, быстро преобразуется ферментом флавинмонооксигеназой в ТМАО, уровень которого показал строгую корреляцию с развитием атеросклероза.
Использование бактериями триметиламинной группы холина для синтеза ТМА поднимает вопрос о существовании подобных метаболических путей для аналогичных соединений, включающих эту группу. Одна из таких молекул – как раз карнитин (рис. 3). Возникшее предположение о связи продукции ТМАО из L-карнитина подтвердилось исследованиями 2013 года [1], хотя предшествующие эксперименты на крысах не выявляли такой связи [4].
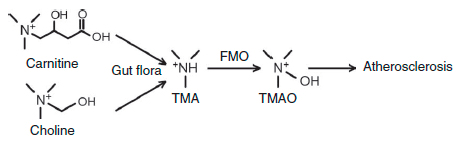
Рисунок 3. Схема синтеза ТМАО, приводящего к развития атеросклероза. Карнитин и холин – триметиламины, получаемые с пищей, – используются для синтеза ТМА микрофлорой кишечника, который быстро окисляется флавинмонооксигеназой до ТМАО.
Метаболит L-карнитина – одна из причин развития сердечнососудистых заболеваний
Два независимых клинических исследования показали связь концентрации L-карнитина и ТМАО в плазме крови с развитием коронарной и периферической недостаточностей, а также сердечнососудистых заболеваний в целом. В первом исследовании участвовала группа из 2595 человек [1], во втором – проводился трехлетний кардиологический контроль 4000 пациентов [5].
Исследования на мышах также подтверждают корреляцию высокого уровня L-карнитина и ТМАО с развитием патологий сердечнососудистой системы [1]. С четырехнедельного возраста четыре группы мышей получали питание определенного типа: 1) обычное, 2) с повышенным содержанием карнитина, 3) с добавлением антибиотиков или 4) с повышенным содержанием карнитина и добавлением антибиотиков. Сравнение ткани корней аорты у мышей по достижении 19-недельного возраста выявило двойное увеличение области атеросклеротического повреждения при добавлении L-карнитина в корм (рис. 4, 5а). У мышей, получающих L-карнитин в комплексе с антибиотиками, нарушений не возникало. Следовательно, виновники развития сердечнососудистых нарушений – бактерии, участвующие в образовании ТМАО, уровень которого значительно возрастает при потреблении L-карнитина (рис. 5б) и коррелирует с развитием атеросклероза.
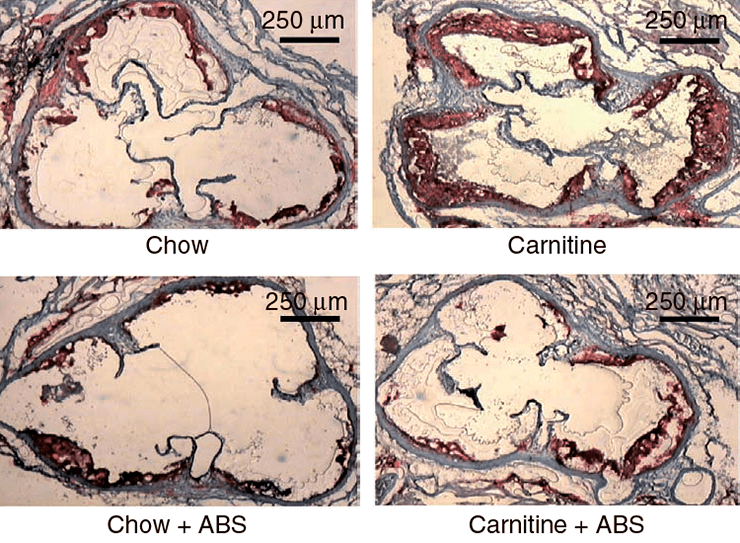
Рисунок 4. Срезы корней аорты 19-недельных мышей. Окраска гематоксилином. Chow – нормальное питание, ABS – отсутствие антибиотика.
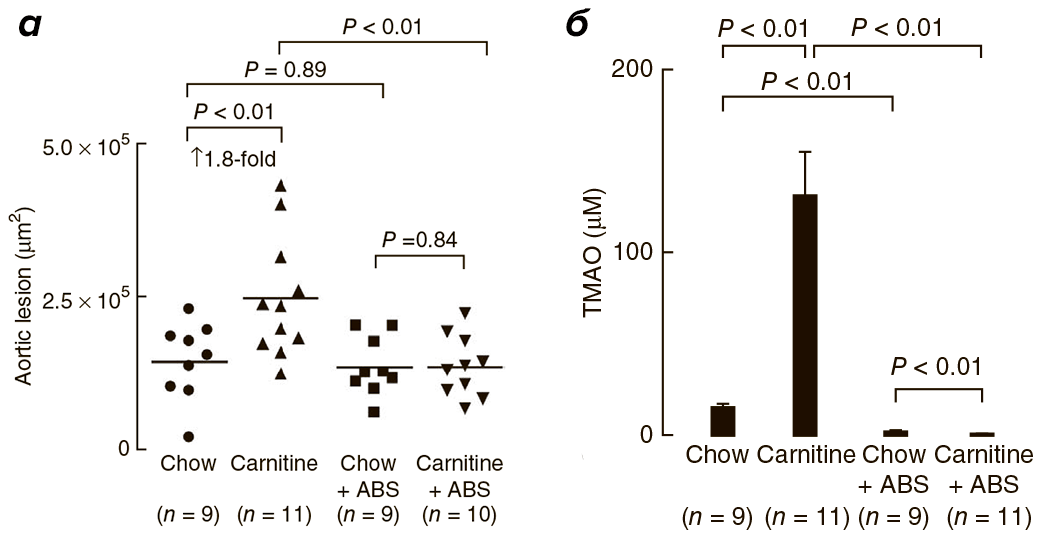
Рисунок 5. а – Оценка площади атеросклеротического повреждения корней аорты у мышей в зависимости от типа питания. б – Зависимость уровня ТМАО от типа питания мышей. Chow – нормальное питание, ABS – отсутствие антибиотика.
Вспомним про веганов (радикальные вегетарианцы, не употребляющие никаких продуктов животного происхождения) и вегетарианцев, не употребляющих красное мясо с высоким содержанием L-карнитина, и задумаемся, есть ли у них в кишечнике группа бактерий, ответственная за образование ТМА, окисляющегося до ТМАО (рис. 3)?
Не секрет, что пищевые предпочтения определяют состав микробиоты [6]. Так, продолжительный избыток карнитина в пище приводит к изменениям состава флоры кишечника, способствуя процветанию бактерий, участвующих в синтезе ТМАО [1]. Сниженное потребление L-карнитина и холина у веганов и вегетарианцев, напротив, не дает им развиваться. Бактерий, синтезирующих ТМАО, практически не остается, и даже при включении L-карнитина в рацион людей, длительное время соблюдающих растительную диету, уровень ТМАО в плазме крови и моче остается низким (рис. 6).
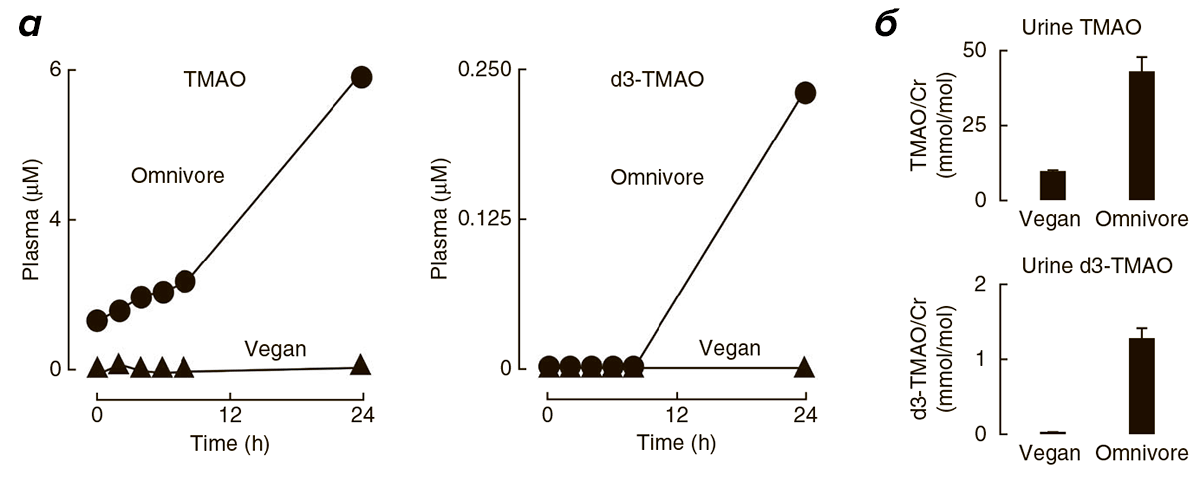
Рисунок 6. Сравнение уровней ТМАО в плазме крови (а) и в моче (б) после приема L-карнитина у веганов и людей, практически ежедневно потребляющих продукты из красного мяса. Синтез ТМАО (или его d3-меченного аналога) после потребления мясного стейка и L-карнитина (или d3-метил карнитина) незначителен у веганов (больше 5 лет отказывающихся от животных продуктов), в отличие от людей, регулярно потребляющих красное мясо. Полученные данные были дополнительно проверены и подтверждены на людях, следующих обычной диете, и людях, ведущих веганский или вегетарианский образ жизни более года.
Из этого можно предположить, что низкий уровень ТМАО и есть основная причина хорошего состояния сердечнососудистой системы веганов и вегетарианцев. Ведь статистика показывает нам более редкую встречаемость сердечнососудистых заболеваний [7], [8] и на 29% сокращенный риск смерти от ишемии сердца для людей этой группы [8].
Эксперименты также говорят о том, что соблюдение сбалансированной растительной диеты приводит к снижению давления, уровня холестерина в крови и риска возникновения атеросклероза [8-10]. Так, отказ от животной пищи может сократить прием лекарств при сердечнососудистых нарушениях. В одном из исследований группе пациентов с атеросклерозом был предложен полный переход на растительную пищу. Через год уже у 82% группы наблюдались улучшения [11]. Повторение эксперимента приводило к сходным результатам [12].
Но, быть может, преимущества соблюдения растительной диеты связаны вовсе не с отсутствием синтеза ТМАО, а с низким содержанием насыщенных жиров и холестерина в рационе? Ведь широко бытует мнение о том, что именно потребление большого количества насыщенных жиров и холестерина является главным фактором риска развития атеросклероза. Однако исследования 2013 года не подтвердили данной связи [1]. Примечательно также, что развитие атеросклеротических поражений у мышей происходило в отсутствие изменений в составе и содержании липидов, липопротеинов, глюкозы и уровня инсулина. Более того, у таких мышей не удалось выявить и признаков ожирения.
Так что возможно, кишечные бактерии, участвующие в синтезе ТМАО, – главные виновники развития атеросклероза. Если это так, то использование антибиотиков – новый возможный способ борьбы с сердечнососудистыми заболеваниями, а также их предотвращения. Как для человека, так и для мышей уже определены роды бактерий, предположительно участвующих в синтезе ТМАО. И хотя полученных данных пока недостаточно для выявления общего таксона, ответственного за синтез ТМАО, дальнейшие исследования вскоре прояснят ситуацию.
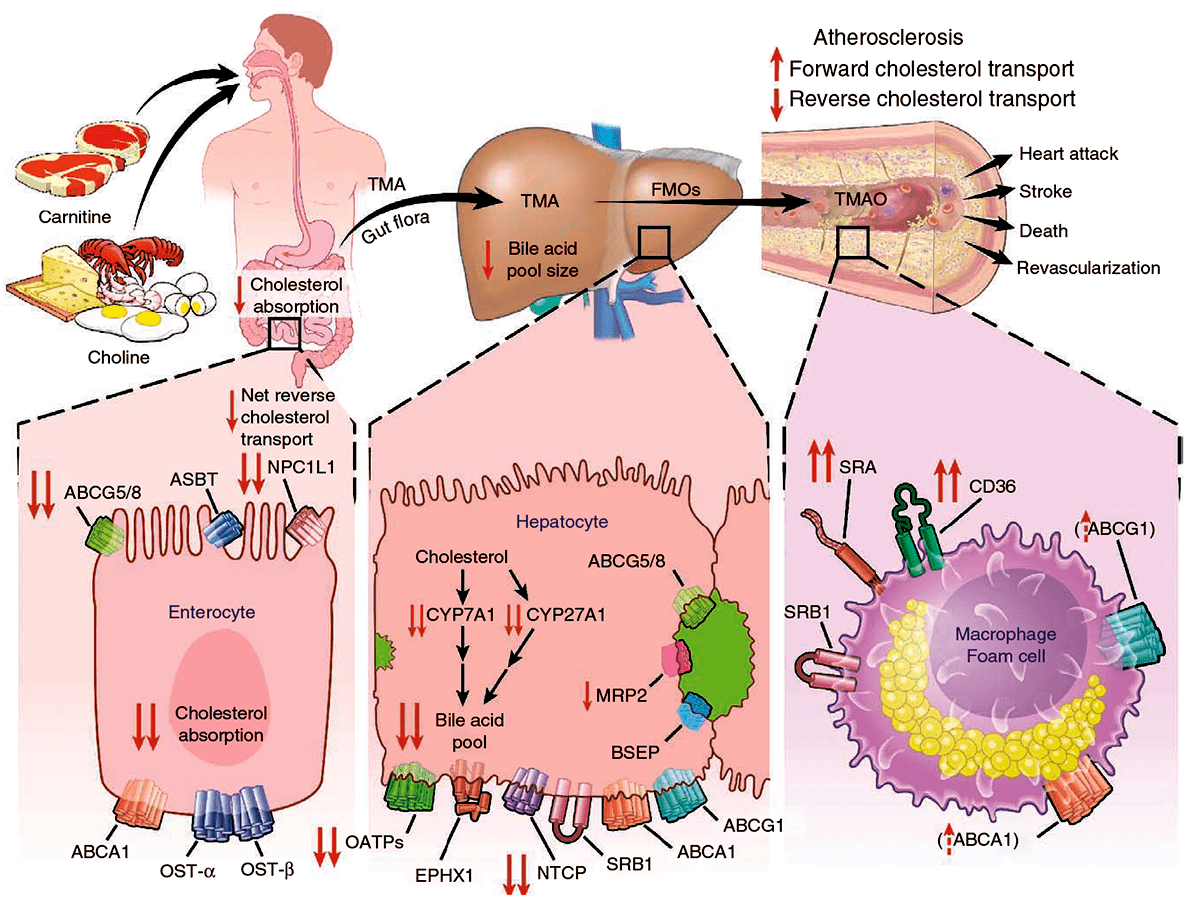
Рисунок 7. Общая схема предполагаемого метаболического пути, посредством которого микробиота влияет на развитие атеросклероза. Кишечные бактерии усваивают L-карнитин и холин, формируя ТМА, а затем ТМАО. ТМАО воздействует на метаболизм холестерина и стерина в макрофагах, печени и кишечнике. Он подавляет обратный транспорт холестерина, увеличивает экспрессию рецепторов SRA и CD36 макрофагов, способствуя образованию пенистых клеток.
Заключение
Вероятно, метаболический путь L-карнитина с участием кишечной микробиоты – главная причина давно замеченной взаимосвязи между обильным потреблением красного мяса и возникновением атеросклероза. Антибиотики, ингибирующие синтез ТМА кишечной флорой, могут стать новым оружием для борьбы и предотвращения сердечнососудистых заболеваний. К тому же открытие синтеза ТМАО из L-карнитина ставит под сомнение убежденность общества в абсолютной безвредности L-карнитина для здоровья и показывает необходимость его дальнейшего исследования.
Литература
- Robert A Koeth, Zeneng Wang, Bruce S Levison, Jennifer A Buffa, Elin Org, et. al.. (2013). Intestinal microbiota bolism of l-carnitine, a nutrient in red meat, tes atherosclerosis. Nat Med. 19, 576-585;
- Gulewitsch W., Krimberg R. (1905). Zur Kenntnis der kivstoffe der Muskein, II Mitteilung. Uber das Carnitin. Hoppe-Seyler’s Z. Physiol. Chem. 45, 326-330;
- Zeneng Wang, Elizabeth Klipfell, Brian J. Bennett, Robert Koeth, Bruce S. Levison, et. al.. (2011). Gut flora bolism of phosphatidylcholine tes cardiovascular disease. Nature. 472, 57-63;
- Rebouche C.J., Mack D.L., Edmonson P.F. (1984). l-Carnitine dissimilation in the gastrointestinal tract of the rat. Biochemistry 23, 6422-6426;
- W.H. Wilson Tang, Zeneng Wang, Bruce S. Levison, Robert A. Koeth, Earl B. Britt, et. al.. (2013). Intestinal Microbial bolism of Phosphatidylcholine and Cardiovascular Risk. N Engl J Med. 368, 1575-1584;
- R. E. Ley, M. Hamady, C. Lozupone, P. J. Turnbaugh, R. R. Ramey, et. al.. (2008). Evolution of Mammals and Their Gut Microbes. Science. 320, 1647-1651;
- Tao Huang, Bin Yang, Jusheng Zheng, Guipu Li, Mark L. Wahlqvist, Duo Li. (2012). Cardiovascular Disease Mortality and Cancer Incidence in Vegetarians: A -Analysis and Systematic Review. Ann Nutr b. 60, 233-240;
- Report of the Dietary Guidelines Advisory Committee on the dietary guidelines for Americans, 2010: to the Secretary of Agriculture and the Secretary of Health and Human Services. (2010). Washington, DC: Agriculture Re Service, US Department of Agriculture, US Department of Health and Human Services;
- Philip Tuso. (2013). Nutritional Up for Physicians: Plant-Based Diets. permj. 17, 61-66;
- Yoshiko Takahashi, Satoshi Sasaki, Shunji Okubo, Masato Hayashi, Shoichiro Tsugane. (2006). Blood pressure change in a free-living population-based dietary modification study in Japan. Journal of Hypertension. 24, 451-458;
- D. Ornish, S.E. Brown, J.H. Billings, L.W. Scherwitz, W.T. Armstrong, et. al.. (1990). Can lifestyle changes reverse coronary heart disease?. The Lancet. 336, 129-133;
- M. de Lorgeril, P. Salen, J.-L. Martin, I. Monjaud, J. Delaye, N. Mamelle. (1999). Mediterranean Diet, Traditional Risk Factors, and the Rate of Cardiovascular Complications After Myocardial Infarction : Final Report of the Lyon Diet Heart Study. Circulation. 99, 779-785;
- Мировой отчет по неинфекционным заболеваниям. (2010). ВОЗ;
- Global atlas on cardiovascular disease prevention and control. (2011). WHO;
- Russell Ross. (1993). The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature. 362, 801-809;
- Холестериновая страшилка, которая правит миром;
- Хороший, плохой, злой холестерин;
- Maria Febbraio, Eugene A. Podrez, Jonathan D. Smith, David P. Hajjar, Stanley L. Hazen, et. al.. (2000). Targeted disruption of the class B scavenger receptor CD36 protects against atherosclerotic lesion development in mice. J. Clin. Invest.. 105, 1049-1056;
- Hiroshi Suzuki, Yukiko Kurihara, Motohiro Takeya, Nobuo Kamada, Motoyukl Kataoka, et. al.. (1997). A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection. Nature. 386, 292-296.
Источник
В последние десятилетия отмечается неуклонный рост числа больных хроническими цереброваскулярными заболеваниями [1, 2, 7, 8]. В МКБ-10 выделена «хроническая ишемия головного мозга» (ХИМ), которая по распространенности занимает ведущее место в структуре цереброваскулярных заболеваний. В отечественной литературе вместо ХИМ часто используется термин «дисциркуляторная энцефалопатия»), под которым подразумевается заболевание с прогрессирующим многоочаговым диффузным поражением головного мозга, проявляющееся неврологическими нарушениями различной степени, обусловленными редукцией мозгового кровотока, повторными транзиторными ишемическими атаками или перенесенными инфарктами мозга [6]. В зависимости от выраженности клинических проявлений в отечественной литературе принято выделять 3 стадии хронической недостаточности мозгового кровообращения [4].
ХИМ – гетерогенный патологический процесс. Учитывая сложность патогенетических механизмов ХИМ, а также ряд основных клинических проявлений, не представляется возможным свести выбор терапевтического воздействия до какого-либо единственного лекарственного или физического фактора. В последние годы все больший интерес в клинической практике привлекает возможность применения L-карнитина.
Карнитин был впервые синтезирован в 1960 г.; в 1962 г. была определена роль карнитина как основного переносчика длинноцепочечных жирных кислот в митохондрии через их внутреннюю мембрану [9].
В настоящее время известно, что эффективность работы митохондрий во многом определяется количеством транспортировщика жирных кислот – L-карнитина [11]. Карнитин образуется в организме человека эндогенно (при участии витаминов С, В3, В6, В12, В9, железа, лизина, метионина и ряда ферментов), а также поступает с мясной пищей. При недостатке карнитина замедляется окисление жирных кислот в митохондриях, вследствие чего снижается продукция АТФ. Чем меньше карнитина (и его эфиров) содержится в плазме крови человека, тем ниже его работоспособность. Мозговая ткань богата карнитином, причем концентрация его достаточно высока в различных отделах центральной нервной системы, отличающихся по своей функциональной активности (гипоталамус, мозжечок, кора, спинной мозг), при этом его содержание в некоторых других тканях и плазме крови низкое [13].
Существует 2 изомера карнитина – право- и левовращающий (D- и L-формы), обладающие разными химическими и биологическими свойствами. Считается, что в организме человека и животных присутствует L-карнитин, который и является биологически активным и безопасным в применении [5].
Одна из основных функций, выполняемая в организме L-карнитином, – обеспечение транспорта свободных жирных кислот из цитозоля в митохондрии. L-карнитин – необходимый транспортер жирных кислот с длинной цепью через внутреннюю мембрану митохондрий к месту окисления и образования энергии в форме АТФ [10]. По своим химическим свойствам свободные жирные кислоты метаболически инертны и не могут подвергаться биохимическим превращениям до тех пор, пока не будут активированы. Активация свободных жирных кислот происходит на наружной поверхности митохондриальной мембраны при участии коэнзима А в присутствии ионов магния и АТФ. Ацетил-коэнзим, находящийся на наружной поверхности мембраны, катализирует реакции, в ходе которых L-карнитин образует промежуточные соединения ацетилкарнитина. L-карнитин обеспечивает поступление в митохондрии активированных свободных жирных кислот, обеспечивая их проникновение через внутренний слой мембраны. Жирные кислоты, поступающие таким образом в митохондрии, используются в системе бета-окисления, которое по своей эффективности продукции энергии близко к циклу трикарбоновых кислот (цикл Кребса) [15].
С возрастом концентрация в организме карнитина снижается, следствием чего является нарушение метаболических путей, ответственных за производство энергии. Показано, что прием карнитина пожилыми пациентами вызывал прогрессивное увеличение общей мышечной массы и значительное уменьшение физического и умственного утомления в сравнении с группой, принимавшей плацебо [21].
В ряде работ приводятся сведения об эффективности L-карнитина при острых расстройствах мозгового кровообращения [3]. В одном из рандомизированных контролируемых клинических исследований доказано, что регулярный прием L-карнитина снижает тяжесть физического и умственного утомления и улучшает когнитивные способности долгожителей (в возрасте 100 и более лет) [17]. Представляет интерес изучение эффективности применения L-карнитина при начальных формах ХИМ.
Цель настоящего исследования – изучение эффективности L-карнитина у больных с ХИМ 1-й и 2-й стадии.
В сравнительное параллельное клиническое исследование были включены 60 пациентов с установленным диагнозом ХИМ 1-2-й стадии, из них 22 мужчины и 38 женщин, в возрасте от 42 до 74 лет (средний – 61,2±8,2 года).
Отбирались больные в возрасте от 41 года до 74 лет, проходящие амбулаторное или стационарное обследование, состояние которых удовлетворяло критериям МКБ-10 (цереброваскулярная болезнь, ХИМ).
В исследование не включались пациенты с ХИМ 3-й стадии, деменцией, перенесенным инсультом или инфарктом миокарда в анамнезе, другими (несосудистыми) заболеваниями ЦНС, наличием психических заболеваний, наличием в анамнезе язвенной болезни желудка или двенадцатиперстной кишки, сахарного диабета, печеночной и почечной недостаточности, заболеваний щитовидной железы, выраженной недостаточности кровоснабжения, онкологического заболевания. Исключались также пациенты, принимающие или принимавшие менее чем за 4 нед до включения в исследование ноотропные и нейрометаболические препараты, а также препараты, влияющие на системный кровоток.
Все больные были информированы о процедурах и плане лечения, дали письменное согласие на участие в исследовании. Работа была одобрена этическим комитетом Российского национального исследовательского медицинского университета им. Н.И. Пирогова.
Все больные получали базисное лечение по поводу ХИМ, включающее назначение антигипертензивных и антиагрегантных препаратов. Но в зависимости от особенностей терапии в целом больные были разделены на 3 группы. В 1-ю группу вошли 20 больных, которые получали по 1000 мг L-карнитина (препарат карнитон) в сутки в течение 60 дней. Во 2-й группе (20 больных) препарат назначался по 2000 мг в сутки в течение 60 дней. 3-я группа была контрольной, в которой применялась только базисная терапия в течение 60 дней.
Всем больным проводилось соматическое и неврологическое обследование, которое дополнялось клиническим и биохимическим анализом крови, дуплексным сканированием прецеребральных артерий, транскраниальной ультразвуковой допплерографией и магнитно-резонансной томографией (МРТ). Использовались также ряд шкал: адаптированная количественная неврологическая шкала А.И. Федина, краткая шкала оценки психического статуса (Mini Mental e Examination, MMSE), тест «отыскивание чисел» (таблицы Шульте) и шкалы субъективной оценки астении MFI-20.
Больные выделенных групп не отличались по полу и возрасту, а также по сопутствующим заболеваниям.
В частности, у всех обследованных пациентов в анамнезе была артериальная гипертензия, причем группы не отличались по длительности этого заболевания, базовому систолическому и диастолическому АД, частоте сердечных сокращений. Во всех трех изученных группах примерно равное число больных получали гипотензивную терапию.
В изученных группах практически с одинаковой частотой встречались атеросклероз (кардиосклероз, поражение сонных артерий), ожирение и нарушения липидного спектра.
Результаты исследования подвергались статистическому анализу с использованием SY v.10.2 и istica v.6.0. Сравнение средних величин проводилось с помощью критерия Стьюдента – использовались две модификации этого теста для независимых и зависимых выборок. Использовали непараметрические методы статистики – U-тест по методу Манна-Уитни. Критическое значение уровня значимости принималось равным 5% (p<0,05).
Все 60 пациентов, включенных в исследование, прошли полный курс лечения. Больные предъявляли жалобы, характерные для клинических проявлений ХИМ 1-2-й стадии. После курсового лечения в 1-й и 2-й группах пациентов была выявлена положительная динамика в виде регресса большинства предъявляемых до лечения жалоб. С помощью двустороннего критерия Фишера проведено сравнение числа больных в группах с различными жалобами до и после лечения (табл. 1).
Приведенные в табл. 1 результаты свидетельствуют о том, что рассматриваемые показатели достоверно изменялись лишь в двух основных группах. Так, в этих группах к моменту завершения курса лечения достоверно уменьшалась частота жалоб на слабость, снижение работоспособности, ухудшение памяти, головную боль, головокружение, шаткость походки (p<0,05). Существенной динамики показателей «шум в ушах», «нарушение настроения» и «нарушение сна» не было (p>0,05). В контрольной группе достоверной динамики в частоте жалоб до и после лечения не отмечалось (p>0,05).
Существенное различие в динамике жалоб в двух основных группах больных было только при ухудшении памяти, во 2-й группе положительная ее динамика была более выражена (p<0,05). Динамика других жалоб в двух основных группах больных существенно не различалась (p>0,05).
Анализ динамики неврологических расстройств после курса лечения на основании адаптированной количественной неврологической шкалы А.И. Федина показал положительные изменения отдельных неврологических симптомов и синдромов во всех трех группах. Для сравнения данных до и после лечения применялся парный тест Вилкоксона (табл. 2).
Из табл. 2 видно, что достоверные изменения показателей наблюдались в обеих основных группах по параметрам «общемозговые симптомы», «вегетативные расстройства» и «общий балл» (p<0,05). Существенной разницы выраженности динамики неврологических синдромов между этими группами не было (p>0,05). У пациентов контрольной группы достоверной динамики неврологических синдромов после лечения не наблюдалась (p>0,05). По сравнению с контрольной группой как в 1-й, так и во 2-й группах была более выражена динамика обещемозговых и вегетативных симптомов, а также общего балла (p<0,05).
Данные нейропсихологического обследования пациентов по шкале MMSE до и после лечения приведены в табл. 3.
При сравнении показателей нейропсихологического тестирования в начале исследования (1-й визит) статистически достоверных отличий между группами выявлено не было (p>0,05). Данное утверждение распространяется как на отдельные подшкалы теста, так и общий балл, полученный пациентами по данной методике.
Как видно из табл. 3, в 1-й группе статистически достоверные отличия после лечения выявлены по общему баллу шкалы MMSE и по подшкалам «концентрация внимания» и «память» (p<0,05). Во 2-й группе наряду с этими показателями после лечения улучшились показатели по подшкале «воспроизведение» (p<0,05), а также существенно выше был общий балл по шкале по сравнению с 1-й группой (p<0,05). При сопоставлении данных основных групп с контрольной отмечалась более выраженная динамика по субтестам «концентрация внимания» и «память», а также общего балла шкалы MMSE (p<0,05).
В трех изученных группах больных проведено сравнение с помощью парного теста Вилкоксона скорости заполнения таблиц Шульте до и после лечения (табл. 4).
Как видно из табл. 4, на фоне лечения у пациентов 1-й и 2-й групп по сравнению с исходным уровнем уменьшилось время работы со всеми 5 таблицами, но статистически достоверное улучшилось только время работы с 5-й таблицей (p<0,05). При этом более выраженная динамика среднего времени выполнения пяти проб была во 2-й группе пациентов по сравнению с 1-й (p<0,05). В контрольной группе пациентов показатели теста остались практически неизменными. При сравнении показателей основных групп с контрольной достоверной была динамика в основных группах при работе с 5-й таблицей и в среднем времени выполнения пяти проб (p<0,05).
Сравнение с помощью парного теста Вилкоксона выраженности астенических нарушений, фиксируемых по субъективной анкете астении до и после лечения в трех обследованных группах больных, приведено в табл. 5.
Из табл. 5 видно, что в 1-й и 2-й группах наблюдалась статистически значимая динамика общего балла и всех субтестов шкалы во сравнению с исходным уровнем (p<0,05). У пациентов данных групп снизился уровень общей, физической и психической астенизации, повысились активность и уровень мотивации. У пациентов 2-й группы по сравнению с 1-й была более выраженной динамика общей астении и общего балла по шкале (p<0,05).
В контрольной группе пациентов, получавших только базисную терапию, отмечалась тенденция к улучшению показателей по субтесту «активность», не достигавшая статистической значимости (p>0,05) и связанная, по-видимому, с дополнительно проводимыми процедурами. При сравнении показателей основных групп с контрольной более существенной была динамика общего балла и всех субтестов шкалы в основных группах (p<0,05).
Изучаемый препарат показал хороший уровень безопасности и переносимости. У 1 пациента 2-й группы отмечались повышенная раздражительность и нарушения сна (бессонница, сон с частыми пробуждениями), регрессировавшие в течение 1-й недели. У 1 пациента из 1-й группы усилилась головная боль, что совпало по времени с выраженной психотравмирующей ситуацией в семье. Симптомы регрессировали при добавлении к лечению транквилизирующих препаратов. У 1 пациента контрольной группы усилились головная боль и головокружение на фоне перепадов АД (пациент отказывался от приема гипотензивных препаратов) и психотравмирующей ситуации. После нормализации эмоционального фона и цифр АД симптомы регрессировали.
Фармакотерапевтическое воздействие при любой форме ишемического поражения мозга должно быть максимально комплексным и направленным не только на восстановление нормального кровотока в пораженном участке, но и устранение (или ослабление) «ишемического каскада», т.е. комплекса нейрометаболических, нейромедиаторных, нейротрофических и других реакций, непосредственно определяющих развитие дегенеративно-деструктивных изменений и формирование неврологических расстройств.
Симптомокомплекс клинических проявлений ХИМ включал характерные для этого заболевания общемозговые симптомы, вестибуло-кохлеарные расстройства, пирамидную и корково-нуклеарную недостаточность, вегетативные и координаторные нарушения. Характерным для всех пациентов было наличие когнитивных нарушений, у части больных выявлялись психоэмоциональные расстройства в виде тревоги и депрессии. У всех исследованных пациентов наблюдалась выраженная астеническая симптоматика.
Проведенное исследование выявило существенное влияние карнитона на астенический симптомокомплекс при ХИМ. Основная неврологическая симптоматика 1-й стадии ХИМ, по сути, выражается в астеническом синдроме. Головные боли и ощущение тяжести в голове, головокружения, общая слабость, повышенная утомляемость, эмоциональная лабильность, нарушения сна, снижение работоспособности – весь этот набор жалоб характерен для начальной стадии ХИМ. Прием карнитона увеличил работоспособность и ежедневную активность больных, подтверждая таким образом, что нарушения митохондриального гомеостаза могут послужить основой для развития астенических симптомов [16]. Положительное действие карнитона отчетливо прослеживалось в значительном улучшении когнитивных функций (на основании результатов шкалы MMSE и теста Шульте). При этом выявлено дозозависимое влияние препарата. В 1-й группе при приеме 1000 мг в сутки карнитона статистически достоверные отличия после лечения выявлены в общем балле шкалы MMSE и субшкалах «концентрация внимания» и «память», в то время как во 2-й группе (прием карнитона в дозе 2000 мг в сутки) наряду с этими показателями после лечения улучшились показатетели субшкалы «воспроизведение», а также существенно был выше общий балл по шкале MMSE.
Аналогичный дозозависимый эффект карнитона отмечен и при анализе выполнения теста Шульте. Более выраженная динамика теста по среднему времени выполнения пяти проб была во 2-й группе пациентов по сравнению с 1-й.
Подобные эффекты связаны с тем, что в тканях мозга L-карнитин осуществляет транспорт ацетильных остатков из митохондрий в цитозоль, участвуя таким образом в синтезе ацетилхолина и ацетилкарнитина [18, 19]. Нейробиологические эффекты ацетилкарнитина включают прямое влияние на энергетический метаболизм и метаболизм фосфолипидов, клеточных макромолекул (таких как нейротрофные факторы и нейрогормоны), синапсическую морфологию и передачу многочисленных нейротрансмиттеров [20, 22]. Применение карнитона приводит к увеличению содержания L-карнитина в тканях, восстанавливает карнитиновые потери и снижает остроту симптомов при ишемических повреждениях [12, 14].
Источник
