Внутренняя энергия газа кдж сосуд под давлением
Решение задач – занятие, которое любит далеко не каждый. Здесь мы стараемся сделать так, чтобы оно занимало у вас поменьше времени без ущерба для качества самого решения. Тема этой статьи — задачи на внутреннюю энергию.
Подписывайтесь на наш телеграм и читайте полезные материалы для студентов каждый день!
Решение задач: внутренняя энергия
Прежде чем приступать к задачам на внутреннюю энергию тела, посмотрите общую памятку по решению физических задач. И пусть под рукой на всякий случай всегда будут основные физические формулы.
Задача №1. Изменение внутренней энергии
Условие
Воздушный шар объёмом 500 м3 наполнен гелием под давлением 105 Па. В результате нагрева температура газа в аэростате поднялась от 10 °С до 25 °С. Как увеличилась внутренняя энергия газа?
Решение
Для решения будем использовать формулу внутренней энергии идеального газа:
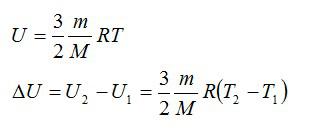
Массу гелия выразим из уравнения Клапейрона-Менделеева:
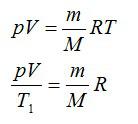
Тогда можно записать:
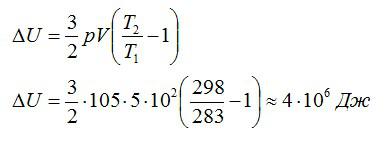
Ответ: 4 МДж.
Задача №2. Внутренняя энергия и работа
Условие
Азот массой 200 г расширяется изотермически при температуре 280 К, причем объём газа увеличивается в 2 раза. Найти:
- Изменение ∆U внутренней энергии газа.
- Совершенную при расширении газа работу А.
- Количество теплоты Q, полученное газом.
Решение
Так как процесс изотермический, то изменение внутренней энергии равно нулю, а работа равна количеству теплоты, полученному газом:
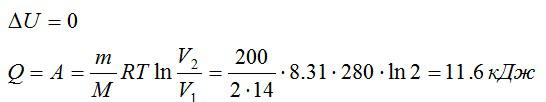
Ответ: 0; 11,6 кДж; 11,6 кДж.
Задача №3. Изменение внутренней энергии при изобарном и изохорном процессе
Условие
Кислород занимает объём V1= 3 л при давлении p1= 820 кПа. В результате изохорного нагревания и изобарного расширения газ переведён в состояние с объёмом V2= 4,5 л и давлением p2= 600 кПа. Найти количество теплоты, полученное газом; изменение внутренней энергии газа.
Решение
Теплота, подведенная к газу, идет на совершение работы и изменение внутренней энергии:
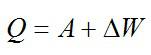
В изохорном и изобарном процессе соответственно:
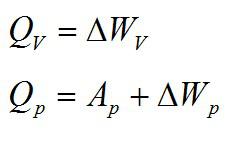
Изохорное нагревание:
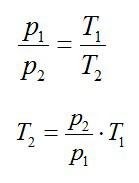
Изменение внутренней энергии при изохорном процессе:
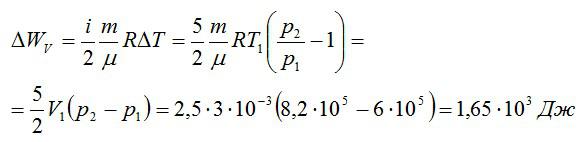
Изменение внутренней энергии при изобарном процессе:
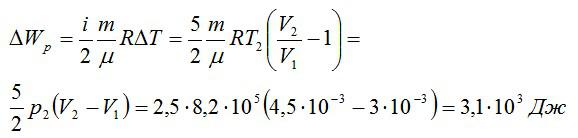
Общее изменение внутренней энергии:
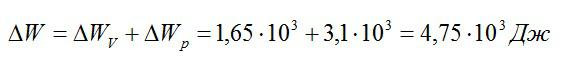
Ответ: 4,75 кДж.
Задача №4. Изменение внутренней энергии двухатомного газа
Условие
Кислород массой 2 кг занимает объём 6 м3 и находится под давлением 1 атм. Газ был нагрет сначала при постоянном давлении до объёма 13 м3, а затем при постоянном объёме – до давления 23 атм. Найти изменение внутренней энергии газа.
Решение
Изменение внутренней энергии находим по формуле:
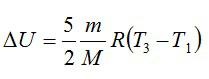
Эту форму можно преобразовать, используя уравнение Клапейрона-Менделеева:
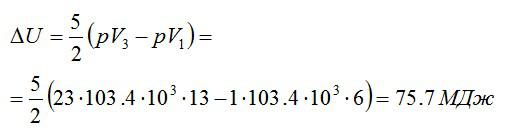
Ответ: 75,7 МДж.
Задача №5. Внутренняя энергия смеси газов
Условие
В закрытом сосуде находится масса m1 = 20 г азота и масса m2 = 32 г кислорода. Определить изменение ΔU внутренней энергии смеси газов при охлаждении ее на ΔТ = 28 К.
Решение
Определим количество молей азота и кислорода, а затем общее количество вещества в смеси соответственно:
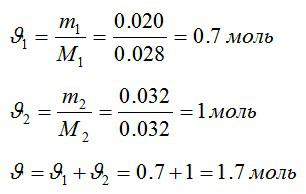
Изменение внутренней энергии:
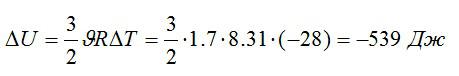
Знак «минус» означает, что внутренняя энергия уменьшается.
Ответ: -539 Дж.
Вопросы на тему «Внутренняя энергия тела»
Вопрос 1. Что такое внутренняя энергия?
Ответ. Для начала, внутренняя энергия чего? Бутылки с пивом, воздуха в шарике, тазика с водой? Все макроскопические тела обладают энергией, заключенной внутри них: атомы твердого тела колеблются в кристаллической решетке около положений равновесия, молекулы газа находятся в постоянном хаотическом движении и т.д.
По определению:
Внутренняя энергия вещества – это энергия, которая складывается из кинетической энергии всех атомов и молекул, и потенциальной энергии их взаимодействия друг с другом.
Для идеального газа с числом степеней свободы i внутренняя энергия вычисляется по формуле:
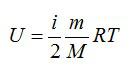
Вопрос 2. От чего зависит внутренняя энергия идеального газа?
Ответ. Эта величина не зависит от объёма и определяется только температурой.
Вопрос 3. Как изменяется внутренняя энергия тела?
Ответ. Если тело совершает работу, его внутренняя энергия уменьшается. Например, газ передвигает поршень. Если же работа совершается над телом, то внутренняя энергия увеличивается.
Вопрос 4. Что такое функция состояния?
Ответ. Функция состояния – это один из параметров, которым можно описать термодинамическую систему. Функция состояния не зависит от того, как система пришла в то или иное состояние, а определяется несколькими переменными состояния.
Внутренняя энергия – это функция состояния термодинамической системы. В общем случае она зависит от температуры и объёма.
Вопрос 5. Можно ли изменить внутреннюю энергию тела, не совершая над ним работы?
Ответ. Да, еще один способ изменения внутренней энергии – теплопередача. В процессе теплопередачи внутренняя энергия тел изменяется.
Нужна помощь в решении задач по любой теме и других студенческих заданий? Профессиональный студенческий сервис поспособствует в выполнении работы вне зависимости от ее сложности.
Источник
Опубликовано чт, 07/18/2019 – 11:01 пользователем fizportal.ru



ОСНОВЫ ТЕРМОДИНАМИКИ. Внутренняя энергия идеального газа. Работа идеального газа. Тема 14-5
14.53. Газ, имевший объем V1 = 10 л и давление p = 2,0 × 105 Па, расширился изобарно до объема V2 = 28 л. Какова работа A, совершенная газом?
14.54. Кислород массы m = 10 г находится под давлением p = 3,0 × 105 Па при температуре t = 10 °С. После изобарного нагревания газ занял объем V2 = 10 л. Найдите изменение внутренней энергии газа и совершенную им работу A.
Ответ
14.55. Гелий массы m = 2,8 г нагревают: а) при постоянном давлении; б) при постоянном объеме. Подведенное к газу количество теплоты в обоих случаях равно ΔQ = 600 Дж. Найдите изменение температуры газа в обоих случаях.
14.56. Для нагревания m = 1 кг неизвестного газа на ΔT = 1 K при постоянном давлении требуется количество теплоты ΔQp = 912 Дж, а при постоянном объеме ΔQV = 649 Дж. Определите молярную массу μ этого газа.
14.57. В сосуде объема V = 10 л находится гелий под давлением p1 = 1,0 × 105 Па. Стенки сосуда могут выдержать Внутреннее давление p2 = 1,0 × 106 Па. Какое максимальное количество теплоты можно сообщить газу в этом сосуде?
14.58. График процесса, происходящего в идеальном газе, представляет собой отрезок прямой. Состояние 1 характеризуется объемом Vo, и давлением 2po, состояние 2 – объемом Vo, и давлением po. Найдите количество теплоты, которое было сообщено газу.
14.59. Определите давление po идеального одноатомного газа, занимающего объем V = 2,0 л, если его внутренняя энергия U = 300Дж.
14.60. Идеальный одноатомный газ массы m нагревают при постоянном давлении так, что значение средней квадратичной скорости молекул изменяется от v1 до v2. Определите количество теплоты ΔQ сообщенное газу.
Ответ
ΔQ = ((i + 2)/2i) × m(v22 − v12), i = 3
14.61. Идеальный одноатомный газ, взятый в количестве ν моль, нагревают при постоянном давлении. Какое количество теплоты следует сообщить газу, чтобы средняя квадратичная скорость его молекул увеличилась в n раз? Начальная температура газа равна To.
Ответ
ΔQ = ((i + 2)/2) × (n2 − 1)νRTo, i = 3
14.62. Масса m идеального газа, находящегося при температуре To, охлаждается изохорно так, что давление падает в n раз. Затем газ расширяется при постоянном давлении. В конечном состоянии его температура достигает первоначального значения. Определите совершенную газом работу A. Молярная масса газа равна ν.
Ответ
A = ((n − 1)/n) × (m/μ) × RTo
14.63. В вертикальном цилиндре с площадью основания S = 100 см2 находится воздух при температуре T = 290 К. На высоте H = 0,6 м от основания цилиндра расположен легкий поршень, на котором лежит груз массы m = 100 кг. Какую работу совершит газ при расширении, если его нагреть на ΔT = 50 K? Атмосферное давление po = 1,0 × 105 Па.
14.64. Некоторое количество газа занимает объем V1 = 0,01 м3 при давлении p1 = 1,0 × 105 Па и температуре T1 = 300 К. Сначала газ нагревают без изменения объема до температуры T2 = 320 К, а затем при постоянном давлении до температуры T3 = 350 К. Найдите совершенную газом работу A.
14.65. В цилиндре под поршнем находится газ. Поршень соединен с дном цилиндра пружиной. При нагревании газа его объем изменяется от V1 до V2, а давление – от p1 до p2. Пренебрегая трением и массой поршня, определите совершенную при этом работу A.
Ответ
A = (1/2)(p1 + p2)(V2 − V1)
14.66. В изотермическом процессе газ совершает работу ΔA = 1000 Дж. Чему будет равно изменение внутренней энергии газа ΔU, если ему сообщить количество теплоты вдвое большее, чем в первом случае, а процесс проводить при постоянном объеме?
14.67. Какова внутренняя энергия одноатомного газа, занимающего при температуре T объем V, если концентрация молекул n?
14.68. Давление ν молей идеального газа связано с температурой по закону: Т = $alpha$p2 ($alpha$ = const). Найти работу газа при увеличении объема от значения V1 до значения V2. Выделяется или поглощается при этом тепло?
Ответ
A = (V22 − V12)/(2$alpha nu$R); тепло поглощается
14.69. Для нагревания некоторого количества газа с молярной массой M = 28 г/моль на ΔT = 14 K при p = const требуется количество теплоты Q = 10 Дж. Чтобы охладить его на ту же ΔT при V = const требуется отнять Q = 8 Дж. Определить массу газа.
14.70. В цилиндре под поршнем находится ν = 0,5 молей воздуха при температуре T = 300 K. Во сколько раз увеличится объем воздуха при сообщении ему количества теплоты Q = 13,2 кДж? Молярная теплоемкость воздуха при постоянном объеме CV = 21 Дж/(моль·К).
14.71. Моль идеального газа совершает цикл из двух изохор и двух изобар. Работа газа за цикл A = 200 Дж. Максимальная и минимальная температуры в цикле отличаются на ΔT = 60 К. Отношение давлений на изобарах равно 2. Найти отношение объемов на изохорах.
14.72. Сосуд, содержащий некоторое количество азота, движется со скоростью v = 100 м/с. На сколько изменится температура азота, если сосуд внезапно остановить?
14.73. При нагревании газа его внутренняя энергия увеличилась от 300 до 700 Дж. Какая работа была совершена газом, если на его нагревание было затрачено 1000 Дж теплоты?
14.74. При изохорном нагревании газа его внутренняя энергия увеличилась от 200 до 300 Дж. Какое количество теплоты было затрачено на нагревание газа?
14.75. При изобарном расширении газ совершил работу 100 Дж, а его внутренняя энергия увеличилась при этом на 150 Дж. Затем газу в изохорном процессе сообщили такое же количество теплоты, как и в первом процессе. На сколько увеличилась внутренняя энергия газа в результате этих двух процессов?
14.76. В изотермическом процессе газ получил 200 Дж теплоты. После этого в адиабатическом процессе газ совершил работу в два раза большую, чем в первом процессе. На сколько уменьшилась внутренняя энергия газа в результате этих двух процессов?
14.77. Моль идеального газа нагревается при постоянном давлении, а затем при постоянном объеме переводится в состояние с температурой, равной первоначальной температуре 300 К. Оказалось, что в итоге газу передано количество теплоты 12,45 кДж. Во сколько раз изменился объем, занимаемый газом? Универсальная газовая постоянная 8,31Дж/(моль × К).
14.78. Один моль идеального газа охладили изохорно так, что его давление уменьшилось в 1,5 раза, а затем изобарно нагрели до прежней температуры. При этом газ совершил работу 8300 Дж. Найдите начальную температуру (в Кельвинах) газа. Универсальная газовая постоянная 8,31 Дж/(моль × К).
14.79. Температура идеального газа массой 10 кг меняется по закону $T = alpha V$ ($alpha$ = 2 К/м3). Определите работу (в мДж), совершенную газом при увеличении объема от 2 л до 4 л. Молярная масса газа 12 кг/кмоль, универсальная газовая постоянная 8,31 Дж/(моль·К).
Источник
Пример 1.
Определите количество теплоты, поглощаемое водородом массой 0,2кг при
нагревании его от температуры 0˚C до температуры 100˚C при
постоянном давлении. Найдите также изменение внутренней энергии газа и
совершаемую им работу.
Дано
Решение
m=0,2кг
t1=0˚C,
Т1=273К
t2=100˚C,
Т2=373К
________________
∆U – ? Q – ? А – ?
Количество теплоты, поглощаемое газом при изобарном нагревании:
,(1)
где m – масса нагреваемого газа, cp – его удельная теплоемкость
при постоянном давлении, ∆T – изменение температуры газа. Как известно,
.
Подставив cp в формулу (1), получим:
.
Внутренняя энергия:
.
Следовательно, изменение внутренней энергии
.
Работу расширения газа определим из первого начала термодинамики:
, откуда .
Произведя вычисления, найдем Q=291кДж; А=83кДж,
∆U=208кДж
Пример 2. 10г кислорода находятся
под давлением 300кПа при температуре 10˚C. После нагревания при р=const
газ занял объем 10л. Найдите количество теплоты Q, полученное газом,
изменение ∆W внутренней энергии газа и работу А, совершенную газом при
расширении.
Дано
Решение
m=10-2кг
р=3×105Па
Ср=29,1Дж/моль·К
t=10˚C
Т=283К
V=10л=10-2м3
________________
А-? Q-? ∆U-?
Количество теплоты, полученное газом, определяется следующим
соотношением:
(1) |
Молярная теплоемкость кислорода при р=const;
Ср=29,1Дж/моль·К. Запишем уравнение состояния газа до и после нагревания:
(2) | |
(3) |
Вычитая из (3) уравнение (2), получим:
(4) |
Из (2) выразим
(5) |
Из (4) для ∆T с учетом (5):
(6) |
Тогда уравнение (1) можно записать в виде:
.
Изменение внутренней энергии кислорода:
.
или, подставляя (6):
.
Работа, совершаемая при изменении объема газа:
или с учетом (5)
.
Произведя вычисления, получим: А=2,26 кДж, Q=7,92кДж,
∆U =5,66кДж
Пример 3 . Кислород занимает объем
1м3 и находится под давлением 200кПа. Газ нагрели сначала при
постоянном давлении до объема 3м3, а затем при постоянном объеме
до давления 500кПа. Постройте график процесса и найдите: 1) изменение
∆U внутренней энергии газа; 2) совершенную им работу А; 3) количество
теплоты Q, переданное газу.
Дано
Решение
V1=1м3
р1=2×105Па
V2=3м3
р2=5×105Па
________________
∆U-? А-? Q-?
Построим график процесса.

На графике точками 1,2,3 обозначены состояния газа, характеризуемые
параметрами (р1, V1, T1), (р1, V2,
T2), (р2, V2, T3).
1) Изменение внутренней энергии газа при переходе его из
состояния 1 в состояние 3 равно , где cv – удельная
теплоемкость газа при постоянном объеме; m – масса газа; ∆T – разность
температур, соответствующих конечному 3 и начальному 1 состояниям; т.е. .
Так как ,
где μ – молярная масса газа, то
(1) |
Температуры T1 и T3 выразим из уравнения Менделеева –
Клапейрона
: ,
.
С учетом этого, равенство (1) перепишем в виде:
(2) |
2) Полная работа, совершаемая газом: А=А1+А2,
где А1 – работа на участке 1-2; А2 – работа на участке
2-3. На участке 1-2 давление постоянно (p=const). Работа в этом случае: А1=р1.
На участке 2-3 объем газа не изменяется и, следовательно, работа газа на этом
участке равна нулю (А2=0). Таким образом
(3) |
3) Согласно первому началу термодинамики количество теплоты
Q, переданное газу, равно сумме работы А, совершенной газом, и изменению
∆U внутренней энергии:
(4) |
Произведем вычисления по формулам (2), (3), (4):
Q=3,65МДж, ∆U=3,25МДж, А=0,4МДж.
Пример 4. Работа изотермического
расширения 10г газа от объема V1 до V2=2V1
оказалась равной 575Дж. Найдите среднюю квадратичную скорость молекул газа
при этой температуре.
Дано
Решение
m=10-2кг
А=575Дж
________________
<υкв> – ?
Работа изотермического расширения газа
.
Тогда:
(1) |
Средняя квадратичная скорость молекул:
(2) |
Из выражения (1) найдем
(3) |
Подставим (3) в формулу (2), получим
(4) |
Произведем вычисления: <υкв>=500м/с.
Пример 5. Вычислите показатель
адиабаты смеси водорода и неона, если массовые доли газов в смеси одинаковы.
Дано
Решение
k=0,5
i1=5
i2=3
μ2=20.10-3кг/моль
μ1=2.10-3кг/моль
________________
γ-?
Показатель адиабаты равен ,
где сp и cv – удельные теплоемкости
при постоянном давлении и постоянном объеме.
Удельную теплоемкость при постоянном объеме смеси газа
найдем, используя соотношения:
(1) | |
(2) |
Из соотношений (1) и (2) следует
где и – массовые
доли водорода и неона, соответственно. Учитывая, что k1=k2,
получаем
Рассуждая аналогично, получим формулу для вычисления
удельной теплоемкости при постоянном давлении
.
Учитывая, что и , получим ,
,
отсюда
(3) |
Вычисления дают γ=1,42.
Пример 6. При адиабатном расширении объем азота увеличился
в пять раз, а внутренняя энергия уменьшилась на 4кДж. Определите массу азота,
если начальная температура его была 400К.
Дано
Решение
При адиабатном расширении произошло изменение внутренней энергии ,
отсюда
(1) |
Для определения температуры T2 используем
уравнение адиабаты,
откуда
,
тогда
(2) |
Подставив (2) в (1), получим
(3) |
Произведем расчеты по формуле (3), получим m=28г.
Пример 7. Идеальный двухатомный газ,
занимающий объем 4л при давлении 300кПа, расширяется адиабатно до объема 6л.
Затем в ходе изохорного охлаждения давление газа падает до 100кПа. Определите
работу газа, изменение внутренней энергии и количество теплоты, отданное
газом. Изобразите процесс графически.
Дано
Решение
V1=4·10-3м-3
V2=6·10-3 м-3
p1=3·105Па
p3=105Па
________________
Изобразим процесс графически на рV – диаграмме
Работа газа . Работа A23=0, т.к.
участок 2→3 изохорный процесс. Тогда A=A12. При адиабатном
процессе
(1) |
Запишем уравнение Менделеева-Клапейрона для состояний 1 и
2
; | (2) |
Теперь формулу (1) преобразуем с учетом (2), к виду:
(3) |
Из уравнения адиабаты следует, что ; тогда
(4) |
Решая совместно уравнения (3) и (4), получаем
(5) |
Изменение внутренней энергии или, с
учетом уравнения Менделеева-Клапейрона,
(6) |
Количество теплоты, отданное газом, . При
адиабатном процессе , тогда . При изохорном процессе
или, с учетом уравнения Менделеева-Клапейрона,
(7) |
Произведем вычисления по формулам (5), (6) и (7):
Пример 8. Идеальный двухатомный газ
расширяется согласно уравнению , где n=1,2.
При расширении объем газа увеличивается в 2 раза. Определите изменение внутренней
энергии газа и совершенную им работу, если в начале процесса объем газа был
равен 6л, а давление – 2·105 Па. Чему равна молярная теплоемкость
в этом процессе?
Дано
Решение
V1=6·10-3м3
P1=2·105Па
V2=12·10-3м3
n=1,2
_________________
∆U; A; C – ?
Процесс расширения газа является политропическим.
Изменение внутренней энергии газа можно рассчитать по
формуле
Данное выражение преобразуем, используя уравнение Менделеева-
Клапейрона:
(1) |
Давление p2 найдем, используя уравнение политропы
pVn=const, откуда
,
тогда
(2) |
Из (2) и (1), следует, что
(3) |
Работу газа рассчитывают по формуле
.
Так как , то .
Подставим это выражение в формулу для работы:
Учитывая, что ,
(4) |
Молярная теплоемкость газа
(5) |
С учетом выражений (1) и (4) первое начало термодинамики
запишем в виде
,
или
.
Используя уравнение Менделеева-Клапейрона, имеем
(6) |
Подставим выражение (6) в (5):
(7) |
Произведем вычисления по формулам (3), (4) и (7):
.
Пример 9. Водород массой 20г
находится в цилиндре под поршнем при температуре 300К. При адиабатном
расширении объем водорода увеличился в пять раз. Затем при изотермическом
сжатии объем водорода уменьшился до первоначального значения. Изобразите
процесс графически. Определите совершенную водородом работу и его конечную
температуру.
Дано
Решение
m=0,02кг
T1=300K
________________
T2; A-?
Изобразим процесс графически на рV -диаграмме

Для определения температуры T2 воспользуемся
уравнением адиабаты
,
отсюда
(1) |
Работа водорода . Работу A12
при адиабатическом расширении определим по формуле
.
Работу A23 при изотермическом сжатии найдем по
формуле
.
Тогда
(2) |
Произведем вычисления по формулам (1) и (2): T2=158K;
A=8,8кДж.
Пример 10. Найти для идеального газа
уравнение такого процесса, при котором теплоемкость газа изменяется с
температурой по закону С=α/Т, где α=const.
Дано
Решение
С=α/Т
а=const
_________________
Урав-ие проц-са – ?
Процесс не политропный. Поэтому применив первое начало
термодинамики в форме
.
для одного моля газа:
Используя уравнение Менделеева-Клапейрона перепишем это
уравнение в виде
Разделив левую и правую части на RT, после интегрирования
получаем
.
Отсюда находим искомое уравнение процесса:
.
Пример 11. Некоторый газ массой 1 кг находится при температуре Т=300 К и под давлением р1=0,5 МПа. В результате
изотермического сжатия давление газа увеличилось в два раза. Работа,
затраченная на сжатие, А=-432 кДж. Определите: 1) какой это газ; 2) первоначальный
удельный объем газа.
Дано
Решение
m=1 кг
Т=300 К
р1=5·105Па
р2=2р1
А=-4,32 105Дж
________________
газ-?
υ1-?
, , ;
, ,
, ,
, .
Произведем вычисления: газ- гелий; υ1 =
1,25 м3/кг.
Пример 12. В цилиндрах
карбюраторного двигателя внутреннего сгорания газ сжимается политропически
так, что после сжатия температура газа становится равной t2 =427оC.
Начальная температура t1=140оC газа. Степень сжатия V2
/V1=5,8. Найти показатель политропы n.
Дано
Решение
t2=427оC
V2/V1=5,8
t1=140оC
_________________
n-?
Из уравнения политропического процесса:
или .
Прологарифмируем полученное выражение:
или ,
откуда
;
n=1,3
Пример 13. Работа расширения
некоторого двухатомного идеального газа составляет А=2 кДж. Определите
количество подведенной к газу теплоты, если процесс протекал: 1) изотермически;
2) изобарно.
Дано
Решение
А=2кДж=2 103Дж
I=5
1) Т=const
2) p=const
________________
Q1-?
Q2-?

Рис. 6
, ,
,
;
, , , ,
, , ,
.
Вычисляем Q1 = 2кДж; Q2 = 7кДж.
Пример 14. В цилиндрах
карбюраторного двигателя внутреннего сгорания газ сжимается политропически до
V2=V1/6. Начальное давление р1=90 кПа,
начальная температура t1=127oC. Найти давление р и
температуру t газа в цилиндрах после сжатия. Показатель политропы n=1,3.
Дано
Решение
V2=V1/6
t1=127oC
n=1,3
р1=90 кПа
_________________
р2-?
t2-?
Уравнение политропического процесса
По условию , следовательно,
,
откуда . Из уравнения
политропического процесса
или
Пример 15. Кислород, занимающий при
давлении р1=1МПа объем V1=5л, расширяется в n=3 раза.
Определите конечное давление и работу, совершенную газом. Рассмотрите следующие
процессы: 1) изобарный; 2) изотермический; 3) адиабатный.
Дано
Решение
m=32 10-3
кг/моль
i=5
р1=106Па
V1=5л=5 10-3м3
V=nV1
п = 3
1) р=const
2) T=const
3) Q=0
_________________
p-?
A-?

,,
, | (1) |
(2) | |
, , | (3) |
; | (4) |
Q=0, A=-ΔU, , , , , | (5) |
, , ,
,
. | (6) |
Произведем вычисления по формулам (1)-(6):
1) p=1 Мпа, А=10 кДж;
2) p=0,33 Мпа, А=5,5кДж;
3) p=0,21 Мпа, А=4,63кДж.
Пример 16. Два моля азота N2,
находившиеся при нормальных условиях, сначала изотермически перевели в
некоторое состояние, а затем квазистатически и адиабатно – в конечном
состояние с объемом, в четыре раза большим начального. Определить работу,
совершенную газом, если в изотермическом процессе ему было сообщено Q=11300
Дж теплоты.
Дано
Решение
Т=273К
p=105Па
V2=4V1
Q=11300 Дж
_________________
А-?
Определим промежуточное и конечное макросостояния системы.
Уравнение Менделеева-Клапейрона приводит к неопределенной системе уравнений.
Используем первое начало термодинамики. Для изотермического процесса
где А1─ работа, совершаемая газом в
изотермическом процессе. Отсюда определяем объем промежуточного состояния: ,
далее, используя уравнение адиабатного процесса, находим
конечную температуру
В этих формулах – показатель адиабаты.
По формуле , получаем изменение внутренней
энергии:
Отсюда получаем А ≈ 4500 Дж. Заметим, что после
нахождения параметров макросостояний можно было бы рассчитывать искомую
работу и непосредственно по формуле
Пример 17 . Газ расширяется
адиабатически, причем объем его увеличивается вдвое, а термодинамическая
температура падает в 1,32 раза. Какое число степеней свободы i имеют молекулы
этого газа?
Дано
Решение
________________
Показатель адиабаты . Из уравнения Пуассона
.
По условию и тогда
или
Отсюда
Тогда
Пример 18. При адиабатном расширении
кислорода (ν=2 моль), находящегося при нормальных условиях, его объем
увеличился в n=3 раза. Определите: 1) изменение внутренней энергии газа; 2)
работу расширения газа.
Дано
Решение
ν=2 моль
Т1=273К
V2=nV1
n=
_________________
ΔU-?
A-?
, Q=0, ,
, , i= ,
, , ,
, (1)
. | (2) |
Вычисляем по (1) и (2): ΔU=-4,03кДж; A=4,03кДж.
Пример 19. Некоторая масса кислорода
занимает объем V1 = 3 л при температуре t1=27°C и
давлении р1=820кПа. В другом состоянии газ имеет параметры V2=4,5
л и р2=600кПа. Найти количество теплоты Q, полученное газом,
работу А, совершенную газом при расширении, и изменении ΔU внутренней
энергии газа при переходе газа из одного состояния в другое: а) по участку
АСВ; б) по участку ADB.
Дано
Решение
V1 = 3л
t1= 27°C
р1= 820кПа
V2 = 4,5л
р2 = 600кПа
_________________
Q-?
А-?
ΔU-?

а) По участку АСВ: участок АС — изохора, т.е. А1
= 0, поскольку ΔV = 0. Следовательно,
.
Согласно уравнению Менделеева – Клапейрона
(1) |
и
. | (2) |
Вычтем уравнение (2) из (1), тогда
.
Отсюда ; Q1=1,65 кДж.
Участок СВ – изобара, следовательно,
; А2=0,9 кДж.
Изменение внутренней энергии
.
Согласно уравнению Менделеева – Клапейрона
(3) |
и
. | (4) |
Вычтем (3) из (4), тогда
.
Отсюда
; ΔU2 = 2,25 кДж.
Таким образом, на всем участке АСВ: работа
А = А2 = 0,9 кДж;
изменение внутренней энергии
кДж.
Согласно первому началу термодинамики количество тепла
кДж.
б) Аналогично на участке ADB: работа
кДж;
изменение внутренней энергии
кДж;
количество тепла кДж.
Источник
