Внутренняя энергия идеального газа в сосуде
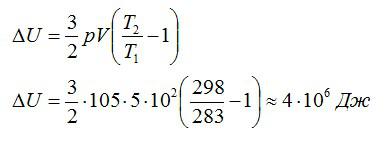
6.2. Первый закон термодинамики
6.2.1. Внутренняя энергия идеального газа
Внутренняя энергия любого вещества — это энергия теплового движения его молекул и энергия их взаимодействия между собой. Модель идеального газа предполагает отсутствие взаимодействия между его молекулами, поэтому внутренней энергией идеального газа принято считать только энергию теплового движения молекул. Внутренняя энергия газа представляет собой сумму кинетических энергий его молекул и определяется формулой
U=N〈Ek〉,
где N — число молекул (атомов), N = νN
A; ν — количество вещества; N
A — постоянная (число) Авогадро, N
A = 6,02 ⋅ 1023 моль–1; 〈Ek〉 — средняя кинетическая энергия одной молекулы, 〈Ek〉=i2kT; i — число степеней свободы; k — постоянная Больцмана, k = 1,38 ⋅ 10−23 Дж/К; T — абсолютная температура.
Число степеней свободы зависит от количества атомов в молекуле газа и имеет следующие значения:
- для одноатомного —
i = 3;
- для двухатомного —
i = 5;
- для трех- и многоатомного —
i = 6.
В Международной системе единиц внутренняя энергия вещества (газа) измеряется в джоулях (1 Дж).
Внутренняя энергия идеального газа определяется формулой
U=i2νRT,
где i — число степеней свободы; ν — количество вещества (газа); R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — абсолютная (термодинамическая) температура вещества.
Внутренняя энергия для одно-, двух-, трех- и многоатомных газов определяется следующими формулами:
- для одноатомного —
U=32νRT;
- для двухатомного —
U=52νRT;
- для трех- и многоатомного —
U = 3νRT.
Изменение внутренней энергии газа определяется разностью
ΔU = U
2 − U
1,
где U
1 — внутренняя энергия начального состояния газа; U
2 — внутренняя энергия конечного состояния газа.
Изменение внутренней энергии газа связано с изменением кинетической энергии движения его молекул. Изменение кинетической энергии движения молекул вещества, в свою очередь, связано с изменением температуры. Следовательно, изменение внутренней энергии газа определяется изменением его температуры.
Изменение внутренней энергии идеального газа рассчитывается по формуле
ΔU=i2νR(T2−T1)=i2νRΔT,
где i — число степеней свободы; ν — количество вещества; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T
2 — абсолютная температура конечного состояния газа; T
1 — абсолютная температура начального состояния идеального газа; ∆T = T
2 − T
1.
Изменение внутренней энергии для одно-, двух-, трех- и многоатомных газов определяется следующими формулами:
- для одноатомного —
ΔU=32νRΔT;
- для двухатомного —
ΔU=52νRΔT;
- для трех- и многоатомного —
∆U = 3νR∆T.
Изменение внутренней энергии газа ΔU при различных процессах также различно и показано в таблице (для одно-, двух-, трех- и многоатомных газов):
Процесс | Одноатомный газ, i = 3 | Двухатомный газ, i = 5 | Трех- и многоатомный газ, i = 6 |
|---|---|---|---|
| Изотермический T = const | |||
| Изохорный V = const | 32νRΔT | 52νRΔT | 3νR∆T |
| Изобарный P = const | 32νRΔT | 52νRΔT | 3νR∆T |
| Циклический |
Внутренняя энергия газа не изменяется (U = const):
- при изотермическом процессе, так как ΔT = 0;
- при циклическом процессе, так как в конце процесса газ возвращается в состояние с исходными параметрами; циклическим (круговым, замкнутым) процессом, или циклом, называется процесс, при котором газ, пройдя ряд состояний, возвращается в исходное.
Пример 1. В ходе некоторого процесса давление и объем постоянной массы идеального одноатомного газа изменяются таким образом, что pV
2 = const, где p — давление в паскалях; V — объем в кубических метрах. Во сколько раз уменьшается внутренняя энергия газа при увеличении его объема в 3 раза?
Решение. Внутренняя энергия идеального одноатомного газа определяется следующей формулой:
- для начального состояния газа —
U1=32νRT1,
где ν — количество вещества (газа); R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T
1 — температура газа в начальном состоянии;
- для конечного состояния газа —
U2=32νRT2,
где T
2 — температура газа в конечном состоянии.
Искомым является отношение
U1U2=3νRT12⋅23νRT2=T1T2.
Найдем отношение температур.
Для этого из уравнения Менделеева — Клапейрона
pV = νRT
выразим давление
p=νRTV
и подставим полученное выражение в заданный в условии задачи закон:
νRTV⋅V2=νRTV=const, или TV = const.
Заданное в условии соотношение между давлением и объемом эквивалентно полученному соотношению между температурой и объемом.
Для двух состояний газа справедливо тождество
T
1V
1 = T
2V
2,
где V
1 — объем газа в начальном состоянии; V
2 — объем газа в конечном состоянии.
Отсюда следует, что отношение температур определяется выражением
T1T2=V2V1,
а искомое отношение внутренних энергий газа равно
U1U2=V2V1=3.
Пример 2. Термоизолированный сосуд, содержащий некоторое количество водорода, движется со скоростью 250 м/с. Как изменится температура газа, если сосуд внезапно остановить? Молярная масса водорода равна 2,0 г/моль. Теплоемкостью сосуда пренебречь.
Решение. Энергия газа в сосуде определяется суммой:
- для движущегося сосуда —
E
1 = U
1 + W
k
1,
где U
1 — внутренняя энергия водорода (двухатомного газа) в движущемся сосуде (энергия теплового движения молекул водорода), U
1 = 5νRT
1/2; ν — количество водорода, ν = m/M; m — масса водорода; M — молярная масса водорода, M = 2,0 г/моль; T
1 — начальная температура водорода; R — универсальная газовая постоянная, R = = 8,31 Дж/(моль ⋅ К); W
k
1 — кинетическая энергия водорода, движущегося вместе с сосудом, W
k
1 = mv
2/2; v — скорость сосуда, v = 250 м/с;
- для остановившегося сосуда —
E
2 = U
2 + W
k
2,
где U
2 — внутренняя энергия водорода (двухатомного газа) в остановившемся сосуде, U
2 = 5νRT
2/2; T
2 — конечная температура водорода; W
k
2 — кинетическая энергия водорода, остановившегося вместе с сосудом, W
k
2 = 0.
По условию задачи обмена энергией между газом в сосуде и окружающей средой не происходит, так как сосуд является термоизолированным; поэтому энергия газа сохраняется
E
1 = E
2,
или, в явном виде, —
U
1 + W
k
1 = U
2 + W
k
2.
Подстановка в полученное равенство выражений для внутренней и кинетической энергий газа в сосуде дает
5mRT12M+mv22=5mRT22M.
Искомая разность температур определяется формулой
ΔT=v2M5R.
Вычислим:
ΔT=(250)2⋅2,0⋅10−35⋅8,31=3,0 К.
При внезапной остановке сосуда, движущегося с указанной скоростью, температура содержащегося в нем водорода повышается на 3,0 К.
Источник
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула | ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс | ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение | ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления | ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс | ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение: A‘=p(V2−V1) A‘>0 |
| Изобарное сжатие: A‘=p(V2−V1) A‘<0 |
| Изохорное охлаждение: V=const A‘=0 |
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
| Замкнутый цикл: 1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
| Произвольный процесс: A‘=p1+p22(V2−V1) |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Алиса Никитина | ???? Скачать PDF | Просмотров: 2k | Оценить:
Источник
Âíóòðåííþþ ýíåðãèþ òåëà ñîñòàâëÿþò êèíåòè÷åñêàÿ ýíåðãèÿ âñåõ åãî ìîëåêóë è ïîòåíöèàëüíàÿ ýíåðãèÿ èõ âçàèìîäåéñòâèÿ.
Âíóòðåííÿÿ ýíåðãèÿ âõîäèò â áàëàíñ ýíåðãåòè÷åñêèõ ïðåâðàùåíèé â ïðèðîäå. Ïîñëå îòêðûòèÿ âíóòðåííåé ýíåðãèè áûë ñôîðìóëèðîâàí çàêîí ñîõðàíåíèÿ è ïðåâðàùåíèÿ ýíåðãèè. Ðàññìîòðèì âçàèìíîå ïðåâðàùåíèå ìåõàíè÷åñêîé è âíóòðåííåé ýíåðãèé. Ïóñòü íà ñâèíöîâîé ïëèòå ëåæèò ñâèíöîâûé øàð. Ïîäíèìåì åãî ââåðõ è îòïóñòèì. Êîãäà ìû ïîäíÿëè øàð, òî ñîîáùèëè åìó ïîòåíöèàëüíóþ ýíåðãèþ. Ïðè ïàäåíèè øàðà îíà óìåíüøàåòñÿ, ò. ê. øàð îïóñêàåòñÿ âñå íèæå è íèæå. Íî ñ óâåëè÷åíèåì ñêîðîñòè ïîñòåïåííî óâåëè÷èâàåòñÿ êèíåòè÷åñêàÿ ýíåðãèÿ øàðà. Ïðîèñõîäèò ïðåâðàùåíèå ïîòåíöèàëüíîé ýíåðãèè øàðà â êèíåòè÷åñêóþ. Íî âîò øàð óäàðèëñÿ î ñâèíöîâóþ ïëèòó è îñòàíîâèëñÿ. È êèíåòè÷åñêàÿ, è ïîòåíöèàëüíàÿ ýíåðãèè åãî îòíîñèòåëüíî ïëèòû ñòàëè ðàâíûìè íóëþ. Ðàññìàòðèâàÿ øàð è ïëèòó ïîñëå óäàðà, ìû óâèäèì, ÷òî èõ ñîñòîÿíèå èçìåíèëîñü: øàð íåìíîãî ñïëþùèëñÿ, è íà ïëèòå îáðàçîâàëàñü íåáîëüøàÿ âìÿòèíà; èçìåðèâ æå èõ òåìïåðàòóðó, ìû îáíàðóæèì, ÷òî îíè íàãðåëèñü.
Íàãðåâ îçíà÷àåò óâåëè÷åíèå ñðåäíåé êèíåòè÷åñêîé ýíåðãèè ìîëåêóë òåëà. Ïðè äåôîðìàöèè èçìåíÿåòñÿ âçàèìíîå ðàñïîëîæåíèå ÷àñòèö òåëà, ïîýòîìó èçìåíÿåòñÿ è èõ ïîòåíöèàëüíàÿ ýíåðãèÿ.
Òàêèì îáðàçîì, ìîæíî óòâåðæäàòü, ÷òî â ðåçóëüòàòå óäàðà øàðà î ïëèòó ïðîèñõîäèò ïðåâðàùåíèå ìåõàíè÷åñêîé ýíåðãèè, êîòîðîé îáëàäàë â íà÷àëå îïûòà øàð, âî âíóòðåííþþ ýíåðãèþ òåëà.
Íåòðóäíî íàáëþäàòü è îáðàòíûé ïåðåõîä âíóòðåííåé ýíåðãèè â ìåõàíè÷åñêóþ.
Íàïðèìåð, åñëè âçÿòü òîëñòîñòåííûé ñòåêëÿííûé ñîñóä è íàêà÷àòü â íåãî âîçäóõ ÷åðåç îòâåðñòèå â ïðîáêå, òî ñïóñòÿ êàêîå-òî âðåìÿ ïðîáêà èç ñîñóäà âûëåòèò.  ýòîò ìîìåíò â ñîñóäå îáðàçóåòñÿ òóìàí. Ïîÿâëåíèå òóìàíà îçíà÷àåò, ÷òî âîçäóõ â ñîñóäå ñòàë õîëîäíåå è, ñëåäîâàòåëüíî, åãî âíóòðåííÿÿ ýíåðãèÿ óìåíüøèëàñü. Îáúÿñíÿåòñÿ ýòî òåì, ÷òî íàõîäèâøèéñÿ â ñîñóäå ñæàòûé âîçäóõ, âûòàëêèâàÿ ïðîáêó (ò. å. ðàñøèðÿÿñü), ñîâåðøèë ðàáîòó çà ñ÷åò óìåíüøåíèÿ ñâîåé âíóòðåííåé ýíåðãèè. Êèíåòè÷åñêàÿ ýíåðãèÿ ïðîáêè óâåëè÷èëàñü çà ñ÷åò âíóòðåííåé ýíåðãèè ñæàòîãî âîçäóõà.
Òàêèì îáðàçîì, îäíèì èç ñïîñîáîâ èçìåíåíèÿ âíóòðåííåé ýíåðãèè òåëà ÿâëÿåòñÿ ðàáîòà, ñîâåðøàåìàÿ ìîëåêóëàìè òåëà (èëè äðóãèìè òåëàìè) íàä äàííûì òåëîì. Ñïîñîáîì èçìåíåíèÿ âíóòðåííåé ýíåðãèè áåç ñîâåðøåíèÿ ðàáîòû ÿâëÿåòñÿ òåïëîïåðåäà÷à.
Âíóòðåííÿÿ ýíåðãèÿ èäåàëüíîãî îäíîàòîìíîãî ãàçà .
Ïîñêîëüêó ìîëåêóëû èäåàëüíîãî ãàçà íå âçàèìîäåéñòâóþò äðóã ñ äðóãîì, èõ ïîòåíöèàëüíàÿ ýíåðãèÿ ñ÷èòàåòñÿ ðàâíîé íóëþ. Âíóòðåííÿÿ ýíåðãèÿ èäåàëüíîãî ãàçà îïðåäåëÿåòñÿ òîëüêî êèíåòè÷åñêîé ýíåðãèåé áåñïîðÿäî÷íîãî ïîñòóïàòåëüíîãî äâèæåíèÿ åãî ìîëåêóë. Äëÿ åå âû÷èñëåíèÿ íóæíî óìíîæèòü ñðåäíþþ êèíåòè÷åñêóþ ýíåðãèþ îäíîãî àòîìà íà ÷èñëî àòîìîâ . Ó÷èòûâàÿ, ÷òî k NA = R, ïîëó÷èì çíà÷åíèå âíóòðåííåé ýíåðãèè èäåàëüíîãî ãàçà:
.
Âíóòðåííÿÿ ýíåðãèÿ èäåàëüíîãî îäíîàòîìíîãî ãàçà ïðÿìî ïðîïîðöèîíàëüíà åãî òåìïåðàòóðå. Åñëè âîñïîëüçîâàòüñÿ óðàâíåíèåì Êëàïåéðîíà-Ìåíäåëååâà, òî âûðàæåíèå äëÿ âíóòðåííåé ýíåðãèè èäåàëüíîãî ãàçà ìîæíî ïðåäñòàâèòü â âèäå:
.
Ñëåäóåò îòìåòèòü, ÷òî, ñîãëàñíî âûðàæåíèþ äëÿ ñðåäíåé êèíåòè÷åñêîé ýíåðãèè îäíîãî àòîìà è â ñèëó õàîòè÷íîñòè äâèæåíèÿ, íà êàæäîå èç òðåõ âîçìîæíûõ íàïðàâëåíèé äâèæåíèÿ, èëè êàæäóþ ñòåïåíü ñâîáîäû, ïî îñè X, Y è Z ïðèõîäèòñÿ îäèíàêîâàÿ ýíåðãèÿ .
×èñëî ñòåïåíåé ñâîáîäû — ýòî ÷èñëî âîçìîæíûõ íåçàâèñèìûõ íàïðàâëåíèé äâèæåíèÿ ìîëåêóëû.
Ãàç, êàæäàÿ ìîëåêóëà êîòîðîãî ñîñòîèò èç äâóõ àòîìîâ, íàçûâàåòñÿ äâóõàòîìíûì. Êàæäûé àòîì ìîæåò äâèãàòüñÿ ïî òðåì íàïðàâëåíèÿì, ïîýòîìó îáùåå ÷èñëî âîçìîæíûõ íàïðàâëåíèé äâèæåíèÿ — 6. Çà ñ÷åò ñâÿçè ìåæäó ìîëåêóëàìè ÷èñëî ñòåïåíåé ñâîáîäû óìåíüøàåòñÿ íà îäíó, ïîýòîìó ÷èñëî ñòåïåíåé ñâîáîäû äëÿ äâóõàòîìíîé ìîëåêóëû ðàâíî ïÿòè.
Ñðåäíÿÿ êèíåòè÷åñêàÿ ýíåðãèÿ äâóõàòîìíîé ìîëåêóëû ðàâíà . Ñîîòâåòñòâåííî âíóòðåííÿÿ ýíåðãèÿ èäåàëüíîãî äâóõàòîìíîãî ãàçà ðàâíà:
.
Ôîðìóëû äëÿ âíóòðåííåé ýíåðãèè èäåàëüíîãî ãàçà ìîæíî îáîáùèòü:
.
ãäå i — ÷èñëî ñòåïåíåé ñâîáîäû ìîëåêóë ãàçà (i = 3 äëÿ îäíîàòîìíîãî è i = 5 äëÿ äâóõàòîìíîãî ãàçà).
Äëÿ èäåàëüíûõ ãàçîâ âíóòðåííÿÿ ýíåðãèÿ çàâèñèò òîëüêî îò îäíîãî ìàêðîñêîïè÷åñêîãî ïàðàìåòðà — òåìïåðàòóðû è íå çàâèñèò îò îáúåìà, ò. ê. ïîòåíöèàëüíàÿ ýíåðãèÿ ðàâíà íóëþ (îáúåì îïðåäåëÿåò ñðåäíåå ðàññòîÿíèå ìåæäó ìîëåêóëàìè).
Äëÿ ðåàëüíûõ ãàçîâ ïîòåíöèàëüíàÿ ýíåðãèÿ íå ðàâíà íóëþ. Ïîýòîìó âíóòðåííÿÿ ýíåðãèÿ â òåðìîäèíàìèêå â îáùåì ñëó÷àå îäíîçíà÷íî îïðåäåëÿåòñÿ ïàðàìåòðàìè, õàðàêòåðèçóþùèìè ñîñòîÿíèå ýòèõ òåë: îáúåìîì (V) è òåìïåðàòóðîé (T).
Источник
Решение задач – занятие, которое любит далеко не каждый. Здесь мы стараемся сделать так, чтобы оно занимало у вас поменьше времени без ущерба для качества самого решения. Тема этой статьи — задачи на внутреннюю энергию.
Подписывайтесь на наш телеграм и читайте полезные материалы для студентов каждый день!
Решение задач: внутренняя энергия
Прежде чем приступать к задачам на внутреннюю энергию тела, посмотрите общую памятку по решению физических задач. И пусть под рукой на всякий случай всегда будут основные физические формулы.
Задача №1. Изменение внутренней энергии
Условие
Воздушный шар объёмом 500 м3 наполнен гелием под давлением 105 Па. В результате нагрева температура газа в аэростате поднялась от 10 °С до 25 °С. Как увеличилась внутренняя энергия газа?
Решение
Для решения будем использовать формулу внутренней энергии идеального газа:
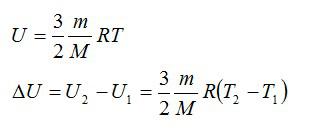
Массу гелия выразим из уравнения Клапейрона-Менделеева:
Тогда можно записать:
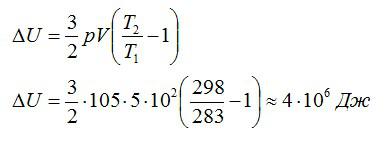
Ответ: 4 МДж.
Задача №2. Внутренняя энергия и работа
Условие
Азот массой 200 г расширяется изотермически при температуре 280 К, причем объём газа увеличивается в 2 раза. Найти:
- Изменение ∆U внутренней энергии газа.
- Совершенную при расширении газа работу А.
- Количество теплоты Q, полученное газом.
Решение
Так как процесс изотермический, то изменение внутренней энергии равно нулю, а работа равна количеству теплоты, полученному газом:
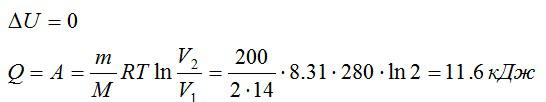
Ответ: 0; 11,6 кДж; 11,6 кДж.
Задача №3. Изменение внутренней энергии при изобарном и изохорном процессе
Условие
Кислород занимает объём V1= 3 л при давлении p1= 820 кПа. В результате изохорного нагревания и изобарного расширения газ переведён в состояние с объёмом V2= 4,5 л и давлением p2= 600 кПа. Найти количество теплоты, полученное газом; изменение внутренней энергии газа.
Решение
Теплота, подведенная к газу, идет на совершение работы и изменение внутренней энергии:
В изохорном и изобарном процессе соответственно:
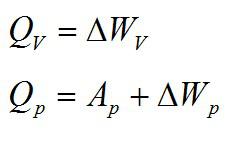
Изохорное нагревание:
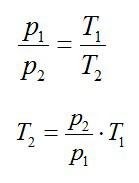
Изменение внутренней энергии при изохорном процессе:
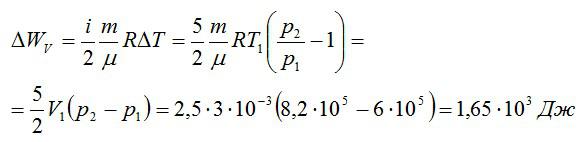
Изменение внутренней энергии при изобарном процессе:
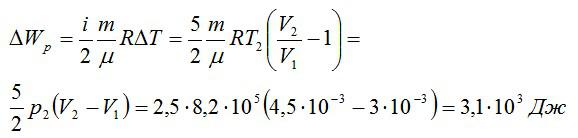
Общее изменение внутренней энергии:
Ответ: 4,75 кДж.
Задача №4. Изменение внутренней энергии двухатомного газа
Условие
Кислород массой 2 кг занимает объём 6 м3 и находится под давлением 1 атм. Газ был нагрет сначала при постоянном давлении до объёма 13 м3, а затем при постоянном объёме – до давления 23 атм. Найти изменение внутренней энергии газа.
Решение
Изменение внутренней энергии находим по формуле:
Эту форму можно преобразовать, используя уравнение Клапейрона-Менделеева:
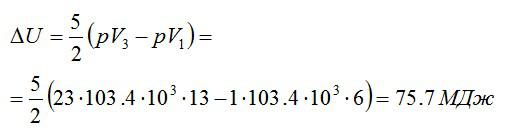
Ответ: 75,7 МДж.
Задача №5. Внутренняя энергия смеси газов
Условие
В закрытом сосуде находится масса m1 = 20 г азота и масса m2 = 32 г кислорода. Определить изменение ΔU внутренней энергии смеси газов при охлаждении ее на ΔТ = 28 К.
Решение
Определим количество молей азота и кислорода, а затем общее количество вещества в смеси соответственно:
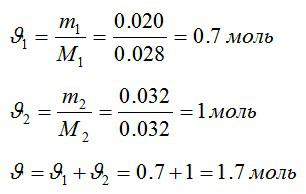
Изменение внутренней энергии:
Знак «минус» означает, что внутренняя энергия уменьшается.
Ответ: -539 Дж.
Вопросы на тему «Внутренняя энергия тела»
Вопрос 1. Что такое внутренняя энергия?
Ответ. Для начала, внутренняя энергия чего? Бутылки с пивом, воздуха в шарике, тазика с водой? Все макроскопические тела обладают энергией, заключенной внутри них: атомы твердого тела колеблются в кристаллической решетке около положений равновесия, молекулы газа находятся в постоянном хаотическом движении и т.д.
По определению:
Внутренняя энергия вещества – это энергия, которая складывается из кинетической энергии всех атомов и молекул, и потенциальной энергии их взаимодействия друг с другом.
Для идеального газа с числом степеней свободы i внутренняя энергия вычисляется по формуле:
Вопрос 2. От чего зависит внутренняя энергия идеального газа?
Ответ. Эта величина не зависит от объёма и определяется только температурой.
Вопрос 3. Как изменяется внутренняя энергия тела?
Ответ. Если тело совершает работу, его внутренняя энергия уменьшается. Например, газ передвигает поршень. Если же работа совершается над телом, то внутренняя энергия увеличивается.
Вопрос 4. Что такое функция состояния?
Ответ. Функция состояния – это один из параметров, которым можно описать термодинамическую систему. Функция состояния не зависит от того, как система пришла в то или иное состояние, а определяется несколькими переменными состояния.
Внутренняя энергия – это функция состояния термодинамической системы. В общем случае она зависит от температуры и объёма.
Вопрос 5. Можно ли изменить внутреннюю энергию тела, не совершая над ним работы?
Ответ. Да, еще один способ изменения внутренней энергии – теплопередача. В процессе теплопередачи внутренняя энергия тел изменяется.
Нужна помощь в решении задач по любой теме и других студенческих заданий? Профессиональный студенческий сервис поспособствует в выполнении работы вне зависимости от ее сложности.
Источник
