Врожденный порок сердца транспозиция магистральных сосудов по мкб
Содержание
- Описание
- Дополнительные факты
- Причины
- Классификация
- Симптомы
- Диагностика
- Лечение
- Прогноз
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Транспозиция магистральных сосудов.
Транспозиция магистральных сосудов
Описание
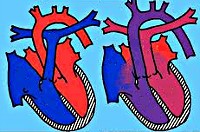
Транспозиция магистральных сосудов. Тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов – отхождением аорты от правых отделов сердца, а легочной артерии – от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Дополнительные факты
Транспозиция магистральных сосудов – врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7-15%. В 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» – наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Особенности гемодинамики при транспозиции магистральных сосудов.
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и тд.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
 Транспозиция магистральных сосудов
Транспозиция магистральных сосудов
Причины
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии – над левым.
Классификация
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
• с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция).
• с ДМЖП.
• с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
• со стенозом выносного тракта левого желудочка.
• с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция).
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Симптомы
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Ассоциированные симптомы: Одышка. Ретикулоцитоз.
Диагностика
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 – менее 20 мм При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых – в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка-Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку-Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга – внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен – в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85-90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Рубрика МКБ-10: Q20.3
МКБ-10 / Q00-Q99 КЛАСС XVII Врожденные аномалии пороки развития, деформации и хромосомные нарушения / Q20-Q28 Врожденные аномалии пороки развития системы кровообращения / Q20 Врожденные аномалии (пороки развития) сердечных камер и соединений
Определение и общие сведения[править]
Транспозиция магистральных сосудов (ТМС)
Транспозиция магистральных сосудов (ТМС) – ВПС (врожденный порок сердца), при котором два основных магистральных ствола расположены аномально: аорта исходит из морфологически правого (венозного) желудочка, а легочный ствол – из морфологически левого (артериального) желудочка. При этом атриовентрикулярные клапаны сформированы и лоцируются правильно, полые вены нормально впадают в правое предсердие, легочные вены – в левое. В результате создаются два разомкнутых круга кровообращения.
Синонимичны такие обозначения порока, как простая ТМС, истинная ТМС, некорригированная ТМС, цианотическая ТМС.
Эпидемиология
Частота порока среди всех ВПС, по клиническим данным, колеблется от 4,2 до 9,9%, а по секционным – от 15,7 до 20,8%. По частоте среди «синих» пороков сердца ТМС занимает 2-е место после ТФ, но это самый частый ВПС, сопровождающийся цианозом и недостаточностью кровообращения у новорожденных, поэтому при катетеризации полостей сердца В.И. Бураковским и соавт. (1973) ТМС у новорожденных обнаружена в 27% случаев, у детей в возрасте до 3 мес – в 16,7% случаев, до 6 мес – в 9,4% случаев, до 12 мес – в 4% случаев, до 2 лет – в 1,2% случаев, старше 2 лет – в 0,5% случаев. По нашим данным, порок выявляется в 1,7% всех случаев ВПС. Порок встречается преимущественно у мальчиков, на долю которых приходится 57-88% всех случаев ТМС
Этиология и патогенез[править]
Гемодинамика. В нормальных условиях БКК (большой круг кровообращения) и МКК (малый круг кровообращения) связываются между собой в последовательной цепи, при транспозиции магистральных сосудов оба круга кровообращения разобщены и функционируют параллельно. Поэтому адаптивно-компенсаторное функционирование сердечно-сосудистой системы возможно только при двустороннем шунтировании и смешении веноартериальной крови обоих кругов кровообращения на уровне естественных и патологических коммуникаций (через бронхиальные артерии, открытое овальное отверстие, ДМПП (дефект межпредсердной перегородки), ДМЖП (дефект межжелудочковой перегородки), ОАП – открытый артериальный проток).
Во внутриутробном периоде из-за особенностей плацентарного кровообращения кровь, поступающая в правое предсердие из верхней полой вены, менее оксигенирована и в основном движется через правый желудочек в восходящую аорту, питая верхние конечности, головной мозг и миокард. Более оксигенированная кровь из нижней полой вены шунтируется через овальное отверстие в левое предсердие и затем через левый желудочек выбрасывается в ствол легочной артерии, откуда через ОАП шунтируется в нисходящую аорту.
Таким образом, в антенатальном периоде, когда кровообращение плацентарное и не функционирует МКК, организм плода через естественные коммуникации снабжается достаточно оксигенированной кровью и его развитие не страдает.
После рождения, с началом функционирования МКК (малый круг кровообращения), кровь из легочного ствола поступает в сосуды МКК, давление в которых прогрессивно снижается, и перестает сбрасываться через ОАП в нисходящую аорту. Повышение давления в аорте и снижение его в легочной артерии приводит к увеличению аортолегочного градиента давления, сбросу крови через ОАП в МКК и возрастанию легочного кровотока. При сохраненном овальном отверстии происходит смешение веноартериальной крови на уровне предсердий, при этом всегда имеется двустороннее шунтирование крови, когда в систолу и диастолу кровь попеременно сбрасывается из одного круга кровообращения в другой.
Необходимость функционирования данного компенсаторного механизма очевидна, ибо в противном случае, при одностороннем сбросе крови, один из кругов кровообращения был бы обескровлен. При наличии двух перегородочных дефектов возможно шунтирование в противоположных направлениях. Естественно, что чем больше коммуникаций и чем шире их просвет, тем значительнее смешение веноартериальной крови и выше ее оксигенация. Наилучшие гемодинамические условия создаются при наличии двух больших перегородочных дефектов.
Другие способы компенсации – коллатеральное кровообращение через бронхиальные сосуды легких, увеличение количества циркулирующей крови и ее кислородной емкости (полицитемия, полиглобулия). Естественно, что даже при наличии всех перечисленных адаптационно-компенсаторных механизмов и коммуникаций, оксигенацию крови нельзя считать адекватной и всегда имеются артериальная гипоксемия и гипоксия.
Ввиду того, что правый желудочек функционирует в режиме БКК (большой круг кровообращения), против высокого периферического сопротивления в аорте, он значительно гипертрофируется. Левый желудочек претерпевает перегрузку объемом из-за увеличенного легочного кровотока, поэтому он гипертрофируется значительно меньше. Однако при наличии сопутствующего стеноза легочной артерии или вследствие развития склеротических изменений в сосудах легких гипертрофия миокарда левого желудочка также становится выраженной.
Клинические проявления[править]
Транспозиция магистральных сосудов – типичный цианотический ВПС (врожденный порок сердца). Однако характер клинических изменений и нарушений гемодинамики в значительной мере обусловлен количеством и размерами сопутствующих компенсирующих коммуникаций и других дефектов, состоянием МКК. Поэтому, несмотря на множество имеющихся классификаций ТМС, большинство вариантов порока можно объединить в две группы.
1. ТМС с нормальным или увеличенным легочным кровотоком:
а) с открытым овальным отверстием или с ДМПП (дефект межпредсердной перегородки);
б) с ДМЖП (дефект межжелудочковой перегородки);
в) с ОАП или их сочетанием.
2. ТМС с уменьшенным легочным кровотоком:
а) со стенозом выходного отдела левого желудочка;
б) с ДМЖП (дефект межжелудочковой перегородки) и стенозом выходного отдела левого желудочка.
У значительного числа больных грудного возраста (80%) выявляется ТМС в сочетании с одной или несколькими коммуникациями, причем в 85-90% этих случаев порок протекает с гиперволемией МКК.
Большинство детей рождаются с нормальной длиной и массой тела и даже с ее превышением. Однако Т.В. Парийская и В.И. Гикавый (1989) обнаруживали умеренное снижение массы тела у 50% таких новорожденных. В дальнейшем быстро прогрессируют гипотрофия и отставание в физическом и психомоторном развитии.
Порок, как правило, диагностируется уже в роддоме по цианозу, имеющемуся у ребенка с первых дней жизни. Интенсивность цианоза различна, но он выявляется практически у всех новорожденных. Наряду с общим цианозом, у большинства детей имеется одышка и тахикардия. Тяжесть цианоза обратно коррелирует с количеством коммуникаций. Самый тяжелый цианоз отмечается при наличии одной коммуникации на уровне овального отверстия. Интенсивность цианоза и одышка значительно возрастают при сосании и плаче. Редко наблюдается дифференцированный цианоз, когда верхняя половина тела более цианотична, чем нижняя: при сочетании ТМС с предуктальной коарктацией аорты и функционирующим ОАП, что обусловливает сброс оксигенированной крови по градиенту давления из легочной артерии через ОАП в нисходящую аорту.
Физикально у новорожденных область сердца не изменена, однако к месячному возрасту быстро нарастает кардиомегалия за счет прогрессирующей гипертрофии и дилатации правого желудочка. Сердечный толчок усилен, видна прекардиальная пульсация. Периферическая пульсация удовлетворительная, АД нормальное. Границы сердца расширены в поперечнике. У более старших детей может возникать центральный сердечный горб. I тон на верхушке громкий, II – акцентирован, особенно при наличии ДМЖП. Позднее, при развитии НК, может выслушиваться трехчленный ритм «протодиастолического галопа».
Независимо от типа сопутствующих дефектов, для ТМС специфичен не только тотальный цианоз, но и рано развивающаяся недостаточность кровообращения. Наиболее тяжело и критически протекают варианты порока, при которых имеется лишь одна коммуникация. В частности, самое неблагоприятное течение с тяжелой одышкой, цианозом, тахикардией и застойной (рефрактерной к терапии) недостаточностью кровообращения наблюдается при простой ТМС, т.е. при наличии небольшой коммуникации в виде незаращенного овального отверстия. Такие больные часто умирают в первые недели жизни.
Клинические проявления ТМС, при сочетании с большим ДМЖП или наличии двух больших перегородочных коммуникаций, выражены слабее, и дети живут более 3-6 мес, так как за счет хорошего смешения крови обеспечивается ее удовлетворительная оксигенация, соответственно уменьшаются гипоксемия и гипоксия. Однако при этом возникают сильная гиперволемия МКК, легочная гипертензия и перегрузка левого желудочка. Следует подчеркнуть, что ранняя рефрактерная недостаточность кровообращения обусловлена не только аномальной циркуляцией крови в двух плохо коммуницируемых кругах кровообращения и значительной объемной и систолической перегрузкой обоих желудочков сердца. В неменьшей степени НК связана с сердечной недостаточностью, обусловленной коронарной гипоксемией из-за поступления в венечные сосуды неоксигенированной крови из аорты.
У детей, которые живут более 3-6 мес, на фоне общего цианоза отмечаются значительное отставание в массе тела, задержка моторных функций и психического развития. Появляются признаки хронической гипоксии – изменение концевых фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»). Грудная клетка вздута (вследствие стойкой гипервентиляции). В результате кардиомегалии развивается сердечный горб. Живот атоничный, увеличен в объеме, печень увеличена, умеренно болезненна. Периферические отеки незначительны. При сочетании ТМС с ДМЖП и ДМПП вследствие гиперволемии МКК у больных отмечается склонность к рецидивирующим бронхитам и застойно-бактериальным пневмониям, на фоне которых может наступать значительное ухудшение состояния и смерть.
Дискордантное желудочково-артериальное соединение: Диагностика[править]
В анализах крови – полицитемия за счет увеличения содержания эритроцитов более 5-6 млн, полиглобулия (концентрация гемоглобина более 180-200 г/л), высокий показатель гематокрита, низкая СОЭ (1-2 мм/ч). Полицитемия и полиглобулия, как и при всех цианотических пороках, компенсаторные, повышают кислородную емкость крови, а снижение СОЭ связано с увеличением вязкости крови. В то же время у некоторых детей развивается релятивная или абсолютная анемия, что ухудшает прогноз заболевания.
Электрокардиография. ЭОС отклонена вправо. У всех больных с ТМС, независимо от сопутствующих дефектов, к 3-4-й нед жизни уже появляются признаки гипертрофии правого желудочка и правого предсердия. К 3-6-му мес жизни при наличии сопутствующего ДМЖП и ОАП может обнаруживаться гипертрофия и левого желудочка в виде сочетанной гипертрофии желудочков с преобладанием правого. Раннее нарастание признаков левожелудочковой гипертофии встречается редко и может свидетельствовать о сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии.
Фонокардиография. Амплитуда I и II тонов хорошая. При простой ТМС в точке 2 ЛС может регистрироваться короткий низкоили среднеамплитудный и среднечастотный систолический шум на 1/3-1/2 систолы, трудноотличимый от функционального шума. При сочетании ТМС с ДМЖП в точке 3-4 ЛС регистрируется высокоили среднеамплитудный высокочастотный шум, занимающий 2/3 систолы. При сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии амплитуда II тона не уменьшается, так как представлена аортальным компонентом II тона, лучше передающегося с расположенного спереди аортального клапана, а систолический высокочастотный среднеамплитудный шум регистрируется преимущественно в точке 2 ЛС.
Эхокардиография. Эхокардиографическая диагностика основана на идентификации основных магистральных сосудистых стволов, желудочков и их клапанного аппарата. В режиме 2D при парастернальном доступе по короткой оси на уровне магистральных сосудов аорта лоцируется спереди (переднеправая или переднелевая позиция) от легочной артерии. Идентификация переднего магистрального сосуда как аорты основывается по направлению хода сосуда вверх, а заднего магистрального сосуда – по ходу назад, с переходом в бифуркацию легочной артерии.
В апикальной позиции по длинной оси левого желудочка выявляются отхождение легочной артерии от левого желудочка и полулунномитральное продолжение, а также параллельная ориентация выводных трактов желудочков и обоих магистральных сосудов.
Косвенными признаками ТМС считаются увеличение толщины стенок и полости правого желудочка.
Рентгенография. Легочный рисунок, как правило, усилен по артериальному руслу, особенно при сочетании ТМС с ДМЖП и ОАП. Характерны форма и размеры сердца, его контуры напоминают «яйцо, лежащее на боку». Обычно сердце увеличено во все стороны. При исследовании в динамике отмечается нарастание с каждым месяцем кардиомегалии, как за счет гипертрофии и дилатации правых отделов сердца, так и за счет утяжеления сердечной недостаточности. Сердце часто становится шарообразной формы с узким сосудистым пучком, обнаруживаемым в сагиттальной проекции, который обусловлен расположением легочной артерии позади аорты. В боковой и косых проекциях сосудистый пучок становится широким.
При сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии легочный рисунок обеднен. Оба желудочка увеличены, однако кардиомегалия менее выражена, чем при большом ДМЖП и гиперволемии МКК. Возможно западение дуги легочной артерии по левому контуру сердца.
Катетеризация полостей сердца позволяет не только провести наиболее информативное диагностическое обследование, но и осуществить ряд лечебных мероприятий (закрытую баллонную атриосептостомию) новорожденным, находящимся в критическом состоянии. Исследования проводят последовательно при катетеризации правых, а затем (через овальное отверстие или ДМПП) и левых отделов сердца.
При ангиографии контрастирующее вещество из правого желудочка попадает преимущественно в восходящую аорту, расположенную спереди. Хорошо видны магистральные сосуды, расположенные параллельно.
Дифференциальный диагноз[править]
Дифференциальный диагноз следует проводить со всеми цианотическими пороками.
Дискордантное желудочково-артериальное соединение: Лечение[править]
Естественное течение и прогноз.
При естественном течении ТМС прогноз неблагоприятный, так как большая часть детей умирают в первые 3-6 мес жизни. В первые недели жизни умирают около 30% больных; к месячному возрасту – 45-50%; к 3 мес жизни – около 70%; к 6 мес жизни – 75%; к 1 году жизни – 80-90%; до 2 лет доживают не более 7% больных. Тем не менее наблюдаются случаи, когда больные доживают до школьного возраста (Shaher R.M., 1973; Paul M., Wernovsry G., 1995). При этом средняя продолжительность жизни, как и характер течения порока, во многом определяется наличием и типом сопутствующих коммуникаций и других дефектов. При простой ТМС и малой величине перегородочных коммуникаций средняя продолжительность жизни не превышает 1-3 мес, при больших перегородочных дефектах – от 8 мес до 2 лет, а при сочетании большого ДМЖП с умеренным стенозом легочной артерии (что является наилучшей корригирующей комбинацией) – до 4-5 лет.
Основными причинами смерти являются сердечная недостаточность, тяжелая гипоксия и ацидоз и часто наслаивающиеся застойнобактериальные пневмонии.
Хирургическая коррекция порока – единственный способ спасения больных, и чем раньше она проведена, тем больше шансов на выживание пациента, так как на поздних этапах возникают тяжелейшие дистрофические изменения во всех органах и тканях, прежде всего в миокарде. Проводят как паллиативные, так и корригирующие радикальные операции. В первые месяцы жизни, особенно при простой ТМС и критических состояниях новорожденных, часто выполняются паллиативные операции, которые позволяют продлить жизнь больных до годовалого возраста, когда радикальные корригирующие операции выполняются легче и лучше переносятся пациентами.
Из паллиативных операций, направленных на создание удовлетворительной коммуникации на уровне предсердий, наиболее простой и наименее травматичной считается закрытая катетерная атриосептостомия (Рашкинда-Парка). Суть операции заключается в том, что катетер с находящимся на его конце баллончиком вводят через правое предсердие и перегородочное отверстие в левое предсердие. Затем баллончик раздувается, и при его выведении через узкое межпредсердное отверстие вновь в правое предсердие осуществляется тракция, при которой происходят разрыв и расширение МПП. При проведении этой операции у детей после 1-2 мес, когда МПП становится более плотной, вначале вводят катетер со складывающимся на его кончике лезвием ножа. Им делают насечки на МПП, а затем баллончиком Рашкинда разрывают и расширяют МПП.
В настоящее время операции Мастарда и Сеннига выполняют редко, а наиболее распространенной корригирующей операцией, выполняемой до 2-3-недельного возраста, является операция Жатене – ретранспозиция магистральных сосудов с реимплантацией венечных артерий (операция switch). Операция выполняется при всех вариантах отхождения венечных артерий. Целесообразно проводить ее пациентам в возрасте 2-3 нед, когда левый желудочек способен поддерживать системное кровообращение.
Летальность после операций Жатене в клиниках, где проведено значительное количество операций switch, составляет менее 10%.
У детей старше 2-3 нед рекомендуется выполнять паллиативную операцию сужения легочного ствола с одновременным наложением системно-легочного анастомоза. Радикальную коррекцию порока по методу Жатене целесообразно проводить через 3-6 мес после паллиативной.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Пороки сердца у детей и подростков: Руководство для врачей [Электронный ресурс] / Мутафьян О.А. – М. : ГЭОТАР-Медиа, 2009. – https://www.rosmedlib.ru/book/ISBN9785970409756.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
