Все газы масса молекул газа в первом сосуде
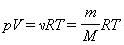
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
- все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
- частицы находятся в непрерывном тепловом движении;
- между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма – частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Объем газа обозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м3.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
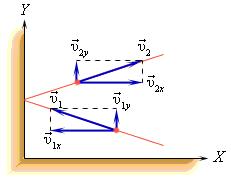
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.
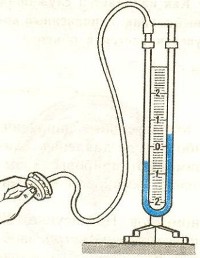
Жидкостные манометры:
- открытый – для измерения небольших давлений выше атмосферного
- закрытый – для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума

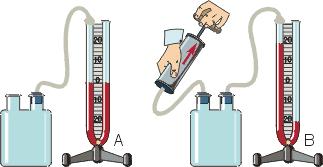
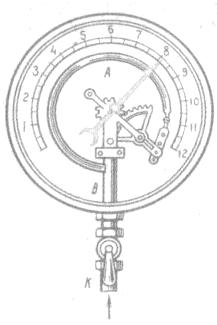
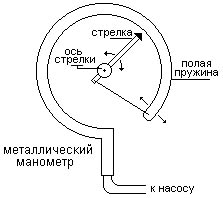
Металлический манометр – для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
Основное уравнение молекулярно-кинетической теории идеального газа.
Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
p = 1/3·m0·n·v2
m0 – масса одной молекулы газа;
n = N/V – число молекул в единице объема, или концентрация молекул;
v2 – средняя квадратичная скорость движения молекул.
Так как средняя кинетическая энергия поступательного движения молекул E = m0*v2/2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v2)/2 = 2/3·E·n
p = 2/3·E·n
Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v2
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
p = nkT
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим или
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
Уравнение Клайперона можно записать в другой форме.
p = nkT,
учитывая, что
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
Соотношение
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pSΔh = R
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Таким образом, R = A.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Источник
1.Обучающие задания по МКТ
1(А) Укажите пару веществ, скорость диффузии которых наибольшая при прочих равных условиях:
1) раствор медного купороса и вода
2) пары эфира и воздух
3) свинцовая и медная пластины
4) вода и спирт
2(А) Какова масса 25 моль углекислого газа?
1) 1,5 кг 2) 1,1 кг 3) 0,9 кг 4) 1,3 кг
Указание: найти молярную массу СО2, по формуле m = νM определить массу.
3(А) Температура железного бруска 41оС , а температура деревянного бруска 285 К. Температура которого бруска выше?
1) железного
2) деревянного
3) температура брусков одинакова
4) сравнивать температуры брусков нельзя, так как они выражены в разных единицах.
Указание: воспользоваться формулой T=t+273.
4(А) На рисунке показана схема опыта Штерна по определению
скорости молекул. Пунктиром
обозначена траектория
атомов серебра, летящих
от проволоки в центре установки через щель во внутреннем цилиндре к внешнему цилиндру при неподвижных цилиндрах. Черным отмечено место, куда попадали атомы серебра при вращении цилиндров. Пятно образовалось когда
1) только внешний цилиндр вращался по часовой стрелке
2) только внутренний цилиндр вращался по часовой стрелке
3) оба цилиндра вращались по часовой стрелке
4) оба цилиндра вращались против часовой стрелки.
5(А) Модель идеального газа предполагает, что…
А. молекулы не притягиваются друг к другу.
Б. молекулы не имеют размеров.
1) только А 3) и А, и Б
2) только Б 4) ни А, ни Б
6(А) Воздух в комнате состоит из смеси газов: водорода, кислорода, азота, водяных паров, углекислого газа и др. Какие из физических параметров этих газов обязательно одинаковы при тепловом равновесии?
1) температура
2) давление
3) концентрация
4) средний квадрат скорости теплового движения молекул.
7(А) В баллоне находится газ, количество вещества которого равно 4 моль. Сколько молекул газа находится в баллоне?
1) 6·1023 2) 12·1023 3) 24·1023 4) 36·1023
Указание: в 1 моле вещества содержится число частиц равное NА.
8(А) Как изменится давление идеального газа на стенки сосуда, если в данном объеме скорость каждой молекулы удвоилась, а концентрация молекул не изменилась?
1) не изменится
2) увеличится в 2 раза
3) увеличится в 4 раза
4) уменьшится в 2 раза
Указание: применить основное уравнение МКТ идеального газа.
9(А) Давление 105 Па создается молекулами газа, масса которых 3·10-26 кг при концентрации 1025 м-3. Чему равна среднеквадратичная скорость молекул?
1) 1 мм/с 3) 300 м/c
2) 1 см/с 4) 1000 м/с
Указание: применить основное уравнение МКТ идеального газа.
10(А) Сколько частиц содержится в 8 г кислорода, если степень его диссоциации 10%?
1) 1,5∙1023 3) 1,35∙1023
2) 1,5∙1022 4) 1,65∙1023
Указание: учесть, что после диссоциации (распада молекул на атомы) 10% от общего числа молекул кислорода распадется на атомы, число которых будет в 2 раза больше, чем число распадающихся молекул.
11(А) Два одинаковых сосуда, содержащие одинаковое число молекул азота, соединены краном. В первом сосуде υср.кв.1 =565 м/с, во втором – υср.кв.2 =707 м/с. Кран открывают. Чему будет равна среднеквадратичная скорость молекул после того, как установится равновесие?
1) 600 м/с 2) 630м/с 3) 636 м/c 4) 640 м/с
Указание: воспользоваться формулой среднеквадратичной скорости.
12(А) Азот (молярная масса 0,028 кг/моль) массой 0,3 кг при температуре 280 К оказывает давление на стенки сосуда, равное 8,3·104 Па. Чему равен объем газа?
1) 0,3 м3 2) 3,3 м3 3) 0,6 м3 4) 60 м3
Указание: воспользоваться уравнением Менделеева-Клапейрона.
13(А) Как изменится давление идеального газа постоянной массы при увеличении абсолютной температуры и объема в 2 раза?
1)увеличится в 4 раза
2) уменьшится в 4 раза
3) не изменится
4) увеличится в 2 раза.
Указание: воспользоваться уравнением Клапейрона.
14(А) Идеальный газ, занимающий объем 15 л, охладили при постоянном давлении на 60 К, после чего объем его стал равным 12 л. Первоначальная температура была равна:
1) 210 К 2) 240 К 3) 300 К 4) 330 К
Указание: воспользоваться уравнением изобарного процесса.
15(А) Газ изохорно охлаждается, а затем
изотермически расширяется. На каком из графиков представлены эти процессы?
1) 3)
p 2
3
Т
2) 4)
1
16(А) На рисунке представлен график изменения состояния
идеального газа. На
основании данных
графика можно сказать,
что давление газа…
1) максимально в состоянии 1
2) максимально в состоянии 2
3) максимально в состоянии 3
4) одинаково во всех состояниях
Указание: Точки 1,2,3 соединить
с началом координат.
Эти прямые соответствуют
изобарным процессам, причем
чем меньше угол наклона
прямой к оси абсцисс, тем больше давление.
17(А) Какое свойство отличает кристалл от аморфного тела?
1) анизотропность 3) твердость
2) прозрачность 4) прочность
18(А) Как изменяется внутренняя энергия вещества при кристаллизации?
1) увеличивается
2) не изменяется
3) уменьшается
4) может увеличиваться или уменьшаться в зависимости от кристаллической структуры тела
19(А) При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это тем, что чаще всего жидкость покидают молекулы, кинетическая энергия которых…
1) …равна средней кинетической энергии молекул жидкости.
2) …превышает среднюю кинетическую энергию молекул жидкости.
3) …меньше средней кинетической энергии молекул жидкости.
4) …равна суммарной кинетической энергии молекул жидкости.
20(А) Давление насыщенного водяного пара при температуре 40оС приблизительно равно 6·103 Па. Каково парциальное давление водяного пара в комнате при этой температуре, если относительная влажность 30 %?
1) 1,8·103 Па 3) 1,2·103 Па
2) 3·103 Па 4) 2·103 Па
Указание: воспользоваться формулой относительной влажности воздуха.
21(А) С помощью психрометрической таблицы определите показания влажного термометра, если температура в помещении 16оС, а относительная влажность воздуха 62%:
1) 20 оС 2) 22 оС 3) 12 оС 4) 16оС
Психрометрическая таблица | |||||||||||||||
Пока-зания сухого термо- метра
| Разность показаний сухого и влажного термометров | ||||||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||||||
Относительная влажность, % | |||||||||||||||
10 12 14 16 18 20 22 | 100 100 100 100 100 100 100 | 88 89 89 90 91 91 92 | 76 78 79 81 82 83 83 | 65 68 70 71 73 74 76 | 54 57 60 62 65 66 68 | 44 48 51 54 56 59 61 | 34 38 42 45 49 51 54 | 24 29 34 37 41 44 47 | 14 20 25 30 34 37 40 | 5 11 17 22 27 30 34 | |||||
Указание: с помощью таблицы определим разность в показаниях сухого и влажного термометров, а затем температуру влажного термометра.
22(В) Два сосуда, содержащих одинаковую массу одного и того же газа, соединены трубкой с краном. В первом сосуде давление 105 Па, во втором 3·105Па. Какое давление установится после открытия крана, если температура в сосудах была одинаковой и не менялась?
Решение:
23(В) Из баллона израсходовали некоторую часть кислорода, в результате чего давление в баллоне уменьшилось от р1 = 8 МПа до р2=6,8 МПа. Какая масса кислорода ∆m была израсходована, если первоначальная масса кислорода в баллоне m=3,6 кг.
Решение:
24(С) Как изменится температура идеального газа, если увеличить его объем в 2 раза при осуществлении процесса, описываемого формулой ?
Решение:
Температура уменьшится в 8 раз.
25(С) Кристалл поваренной соли имеет кубическую форму и состоит из чередующихся ионов Na и Cl. Найти среднее расстояние d между их центрами, если плотность соли ρ = 2200 .
Решение: , , . Так как и , то , d≈2,8·10-10 м.
Источник
Тест 1 блок Молекулярно-кинетическая теория 10 кл.
1. Температура Т = 0ºК:
А) Принципиально не может быть достигнута.
Б) Существует в космосе.
В) Существует в системах элементарных частиц.
Г) Достигнута.
2. Исключи лишнее – модель материального тела в молекулярной физике – это предположение о …
1.Форме тела.
2.Том, из каких частиц состоит тело.
3.О том, как эти частицы двигаются.
4.О том, как они взаимодействуют между собой.
5.Агрегатном состоянии тела:
А) 3,5.
Б) 1,5.
В) 1.
Г) 1,2.
Д) 1,4.
3. Какой температуре по шкале Цельсия соответствует температура Т=152 К?
А) 160 С.
Б) 60 С.
В)-60 С.
Г) 320 С.
Д) -121°С
4. Какими эффектами в газе можно пренебречь для того, чтобы газ считался идеальным?
А) Взаимодействием молекул при столкновении.
Б) Внутренней энергией газа.
В) Массами молекул.
Г) Взаимодействием молекул на расстоянии
Д) Столкновением молекул.
5. Характер движения молекул газа:
А) Совершают хаотическое поступательное движение между двумя последовательными столкновениями
Б) Совершают хаотические колебательные движения около своего положения равновесия.
В) Совершают хаотические поступательные движения от одного равновесного состояния до другого.
Г) Совершают вращательное движение между последовательными столкновениями.
Д) Находятся в равновесном состоянии.
6. Выберите правильные утверждения «Абсолютная термодинамическая температура:
1. Не зависит от термометрического вещества.
2. Устанавливается вторым началом термодинамики.
3. Существует в идеальных системах»:
А) 3
Б) 1,2
В) 1
Г) 2
Д) 1,3
7. Какой температуре по абсолютной шкале Кельвина соответствует температура 690С?
А) 180 К.
Б) 342 К.
В) 316 К.
Г) 204 К.
Д) 300 К.
8. Найти концентрацию молекул, если в 0,01 м3 содержится 8·1010 молекул:
А) 8·1010 1/м3.
Б) 8·104 1/м3.
В) 8 ·10 1/м.
Г) 8·108 1/м3.
Д) 8·106 1/м3.
9. Определить массу одной молекулы, если молярная масса М=32⋅10-3 кг/моль. (NA=6,02·1023 1/моль).
А) .
Б) .
В) .
Г) .
Д) m = 5,3·10кг.
10. Сколько молекул содержится в одном моле кислорода?
А) 12 ⋅1023.
Б) 12 ⋅ 1026.
В) 6 ⋅ 1026.
Г) 6·10.
Д) 1023.
Тест 2 блок Молекулярно-кинетическая теория 10 кл.
11. Число молекул, содержащихся в данной массе m газа с молярной массой М (NA – постоянная Авогадро):
А) (m – M) NA.
Б) .¾¾¾
В)
Г) .
Д) .
12. Масса одной молекулы равна: (NA – число Авогадро, m – масса газа, М – молярная масса, ν – количество молей):
А)
Б) (m – M) NA.
В) ν/M.
Г) nM.
Д) νNA.
13. Сколько молекул содержится в газе объемом 2м3 при давлении 150 кПа и температуре 270С? (NA=6,02·1023 1/моль).
А) 7·10
Б) 0,5 ⋅ 1020.
В) 1 ⋅ 1020.
Г) 3 ⋅ 1020.
Д) 1 ⋅ 1021.
14. Количество молекул, содержащихся в 4 г водорода Н2, (число Авогадро NА = 6,02∙1023 моль -1) равно:
А) 4,816∙1024.
Б) 1,204∙1027.
В) 1,204∙1020.
Г) 4,816∙1021.
Д) 12,04·10
15. При изобарном нагревании идеального газа с начальной температурой 280 К плотность его уменьшилась вдвое. На сколько увеличилась температура газа:
А) 300º.
Б) 200º.
В) 280º.
Г) 180º.
Д)380º.
16. Водород Н2 массой 2 кг при 0˚С и давлении 105 Па занимает объем:
А) 22·10-3 м3.
Б) 0,22 м3.
В) 220 м3.
Г) 2,2 м3.
Д) 22,68 м
17. Известны абсолютные температуры идеального газа Т, количество вещества ν, масса газа m , его молярная масса μ, постоянная Авогадро NА, постоянная Больцмана k, молярная газовая постоянная R. Какой формулой, из приведенных ниже, можно воспользоваться для определения значения произведения давления газа p на его объем V:
1) 2) 3) :
А) Только 1 и 3.
Б) Только 2 и 3.
В) Только 1 и 2.
Г) 1,2 и 3.
Д) Только 1.
18. Плотность азота в закрытом баллоне при повышении температуры от 100 К до 200 К (расширением баллона пренебречь):
А) Останется неизменной
Б) Уменьшится в 4 раза.
В) Уменьшится в 2 раза.
Г) Увеличится в 4 раза.
Д) Увеличится в 2 раза.
19. Из сосуда выпустили половину находящегося в нем газа. Для того чтобы давление его увеличилось в 3 раза, необходимо увеличить абсолютную температуру оставшегося в сосуде газа:
А) В 3 раза.
Б) В 6 раз.
В) В 9 раз.
Г) В 5 раз.
Д) В 2 раза.
20. При температуре 270 С и давлении 105 Па объем газа 1 м3. При какой температуре этот газ будет занимать объем 0,5 м3 при том же давлении 105 Па:
А) 300 К.
Б) 400 К.
В) 600 К.
Г) 150 К.
Д) 450 К.
21. Какой объем займет газ при 770С, если при 270С его объем был 6 л.?
А) 11 л. Б) 2 л. В) 4 л. Г) 9 л. Д) 7 л.
Тест 3 блок Молекулярно-кинетическая теория 10 кл.
22. Температура идеального газа, занимавшего объем V1 = 3 · 10-3 м3, увеличилась в 2 раза при Р = const. После нагревания газ занял объем:
А) 2·10-3 м3 .
Б) 5·10-3 м3.
В) 8·10-3 м3.
Г) 6·10м.
Д) 1,5·10-3 м3.
23. Как изменилось давление идеального газа при переходе из состояния 1 в состояние 2 (рис.)?
А) Могло увеличиться или уменьшится.
Б) Осталось неизменным.
В) Увеличилось.
Г) Уменьшилось.
Д) Процесс невозможен.
24. Как нужно изменить объем газа, чтобы при постоянной температуре его давление уменьшилось в 4 раза?
А) Оставить без изменения.
Б) Увеличить в 2 раза.
В) Уменьшить в 2 раза.
Г) Уменьшить в 4 раза.
Д) Увеличить в 4 раза.
25. При сжатии газа его объем уменьшился с 8 до 5 литров, а давление повысилось на 60 кПа. Найти первоначальное давление. Процесс изотермический:
А) 40 кПа.
Б) 20 кПа.
В) 100 кПа.
Г) 60 кПа.
Д) 80 кПа.
26. На какой глубине радиус пузырька воздуха вдвое меньше, чем у поверхности воды, если атмосферное давление у поверхности воды p0:
А) .
Б) .
В) .
Г) .
Д) .
27. 12г газа занимают объем 4·10-3 м3 при температуре 70 С. После нагревания газа при постоянном давлении его плотность стала равна 6·10-4 г/см3. До какой температуры нагрели газ:
А) 1800 К.
Б) 1400 К.
В) 1500 К.
Г) 1600 К.
Д) 2000 К.
28. При температуре 250 К, давлении 5 · 105 Па в баллоне объемом 0,1 м3 находится воздух. Найти объем воздуха при нормальных условиях:
А) 0,54 м.
Б) 540 м3.
В) 0,88 м3.
Г) 5,4 м3.
Д) 800 м3.
29. При температуре 270С давление газа в закрытом сосуде было 75 кПа. Каким будет давление при температуре -130С?
А) 35 кПа.
Б) 10 кПа.
В) 25 кПа.
Г) 65 кПа.
Д) 45 кПа.
30. Баллон вместимостью 40 л содержит 2 кг углекислого газа. Баллон выдерживает давление не выше 3·106 Па. При какой температуре возникает опасность взрыва?
А) 00С.
Б) -500С.
В) 50ºС.
Г) 200С.
Д) 1000С.
Тест 4 блок Молекулярно-кинетическая теория 10 кл.
31. Какое количество ртути, имеющей кг/ моль, содержится в воздухе объемом 1м3 зараженного ртутью помещения при температуре 20°С, если давление насыщенного пара ртути при этой температуре равно 0,1466 Па?
А) 1 мг. Б) 12 мг. В) 3 мг. Г)6 мг. Д) 24 мг.
32. График процесса, проведенного с большим объемом газа (m = const):
А) 1.
Б) 3.
В) 4.
Г) 5.
Д) 2.
33. Давление некоторой массы идеального газа при переходе из состояния 1 в состояние 2:
А) Могло уменьшиться, могло увеличиться.
Б) Увеличилось.
В) Осталось прежним.
Г) Уменьшилось в 3 раза.
Д) Уменьшилось в 2 раза.
34. Какое давление создает кислород массой 32 кг при температуре 270С, если он находится в сосуде объемом 8,31м3?
А) 3·10-5 Па.
Б) 3·106 Па.
В) 2·103 Па.
Г) 100 кПа.
Д) 3·10 Па.
35. Какие два процесса изменения состояния газа представлены на графиках?
А) 1-изотермический, 2- изобарный.
Б) 1 и 2-изотермические.
В) 1- изобарный, 2-изотермический.
Г) 1-изотермический, 2-изохорный.
Д) 1-изохорный, 2-изотермический.
36. На приведенной p-V диаграмме изотермическим является процесс:
А) 1-3.
Б) 1-2.
В) 1-4.
Г)1-5.
Д) В зависимости от газа либо 1-3, либо 1-4.
37. Сколько молекул содержится в газе объемом 3 м3 при давлении 100 кПа и температуре 27˚С:
А) 5·1025
Б) 3·1025
В)7,2·10
Г) 1·1025
Д) 72·1025
38. Сосуд, содержащий газ под давлением , соединили с пустым сосудом объемом 6 литров. После этого в обоих сосудах установилось давление . Найти объем первого сосуда (процесс изотермический):
А) 10л.
Б) 5л.
В) 3л.
Г) 15 л.
Д) 20л.
39. Оцените температуру газообразного гелия в сосуде, если известно, что его масса равна 4г, объем сосуда 22,4·10-3 м3, давление гелия 105Па. Выберите из приведенных ниже значений наиболее близкое к полученному вами результату:
А) 3 К.
Б) 3000 К.
В) 30000 К.
Г) 30 К.
Д) 300 К.
40. Что называют насыщенным паром?
А) Пар при температуре Т = 0.
Б) Пар с температурой ниже критической температуры.
В) Пар с температурой выше температуры кипения.
Г) Пар при температуре кипения.
Д) Пар, находящийся в динамическом равновесии с жидкостью.
41. При опускании сосуда с водой в глубокую шахту температура кипения:
А) В зависимости от плотности жидкости или уменьшается, или увеличивается.
Б) Не изменяется.
В) Увеличивается.
Г) Уменьшается.
Д) Вначале уменьшается, затем увеличивается.
42. Какое давление рабочей смеси установилось в цилиндре двигателя внутреннего сгорания, если к концу такта сжатия температура повысилась с 47 до 3670С, а объем уменьшился с 1,8 до 0,3 л? Первоначальное давление было 100кПа:
А) 10 МПа.
Б) 1,2 МПа.
В) 2,4 МПа.
Г) 20 МПа
Д) 4,8 МПа.
Тест 5 блок Молекулярно-кинетическая теория 10 кл.
43. В двух сосудах находятся идеальные газы. Масса молекул газа в первом сосуде в 2 раза больше массы молекул газа во втором сосуде. Чему равно отношение давления газа в первом сосуде к давлению газа во втором сосуде при одинаковых значениях концентрации молекул и температуры:
А) 1/2.
Б) 8.
В) 4.
Г) 2.
Д) 1.
44. Как давление насыщенного пара зависит от температуры? С ростом температуры давление:
А) Уменьшается, затем увеличивается.
Б) Увеличивается, затем уменьшается.
В) Возрастает.
Г) Убывает.
Д) Не изменится.
45. Как изменится давление идеального газа, если при неизменной концентрации абсолютная температура газа увеличится в 3 раза:
А) Уменьшится в 3 раза.
Б) Увеличится в 3 раза.
В) Увеличится в 9 раз.
Г) Останется неизменным.
Д) Увеличится в 6 раз.
46. Основное уравнение молекулярно-кинетической теории идеального газа:
А) P =nkT
Б) PV = const.
В) .
Г) PV = 2/3 n0 RT.
Д) PV = RT.
47. Давление идеального газа зависит непосредственно от:
А) Кинетической энергии молекул.
Б) Силы притяжения молекул.
В) Средней длины свободного пробега.
Г) Числа столкновений молекул.
Д) Размеров молекул.
48. Давление газа при увеличении концентрации его молекул в 3 раза и уменьшении средней квадратичной скорости молекул в 3 раза:
А) Увеличится в 9 раз.
Б) Не изменится.
В) Увеличится в 3 раза.
Г) Уменьшится в 3 раза.
Д) Увеличится в 9 раз.
49. Какая из приведенных ниже формул является основным уравнением молекулярно-кинетической теории идеального газа:
А)
Б) p= n(Е).
В)
Г)
Д)
50. Давление идеального газа при увеличении средней квадратичной скорости в 2 раза:
А) Уменьшится в 2 раза.
Б) Увеличится в 4 раза.
В) Увеличится в 2 раза.
Г) Уменьшится в 4 раза.
Д) Останется неизменным.
Тест 6 блок Молекулярно-кинетическая теория 10 кл.
51. В потоке молекул, летящих со скоростью υ под углом α к направлению движения, расположена пластинка. Масса молекулы газа равна m0, концентрация молекул n. Какое давление испытывает пластинка? Удары молекул о пластинку считать абсолютно упругими.
А)
Б) m0nυ2sin2 α.
В) m0nυ2.
Г) 2 m0nυ2sin2 α.
Д)
52. Какую долю средней кинетической энергии молекулы гелия составляет средняя энергия ее вращательного движения:
А) 3.
Б) 1/2.
В) Нуль.
Г) 1.
Д) 2/5.
53. Энергия, приходящаяся на одну степень свободы молекулы водяного пара H2O при 100 К (постоянная Больцмана k=1,38·10 -23 Дж/К):
А) 415,5 Дж.
Б) 3,45⋅10-21 Дж.
В) 2,0775 кДж.
Г) 1,246 кДж.
Д) 6,9·10 Дж.
54. Число степеней свободы молекулы углекислого газа (СО2) равно:
А) 7.
Б) 3.
В) 6.
Г) 5.
Д) 4.
55. Средняя кинетическая энергия поступательного движения хаотически движущейся молекулы двухатомного идеального газа:
А) .
Б) Е = kT.
В) .
Г) .
Д) .
56. Какое из соотношений выражает энергию поступательного движения одной молекулы водорода?
А) 3kT.
Б) .
В) .
Г) kT.
Д) kT.
57. Какова средняя кинетическая энергия атома гелия, если температура газа 170С (постоянная Больцмана k = 1,38·10 -23 Дж/К):
А) 6·10 Дж.
Б) 10-10 Дж.
В) 4·10-10 Дж.
Г) 6 Дж.
Д) 5·10-21 Дж.
58. Из ниже перечисленных газов самое большое число степеней свободы имеют молекулы:
А) H2.
Б) O2.
В) Не.
Г) Аr.
Д) NO.
59. Чему равна кинетическая энергия вращательного движения всех молекул одного моля двухатомного газа?
А) .
Б) .
В) RT
Г) .
Д) 3RT.
60. Величина среднеквадратичной скорости поступательного движения молекул идеального газа:
А) .
Б)
В) .
Г) .
Д) .
61. На поступательное движение молекулы водорода приходится число степеней свободы:
А) 5.
Б) 2.
В) 4.
Г) 3.
Д) 6.
62. На вращательное движение молекулы кислорода приходится число степеней свободы:
А)2.
Б) 1.
В) 3.
Г) 5.
Д) 6.
Тест 7 блок Молекулярно-кинетическая теория 10 кл.
63. Внутренняя энергия 1 моля идеального одноатомного газа при 27ºС равна:
А) 3,74 кДж.
Б) 2,16 кДж.
В) 6,12 кДж.
Г) 1,82 кДж.
Д) 0,59 кДж.
64. Какая из приведенных ниже формул определяет внутреннюю энергию идеального газа:
А) .
Б) U = RT.
В) .
Г) .
Д) .
65. Газ перешел из состояния 1 в состояние 2. Как изменилась его внутренняя энергия?
А) Вначале уменьшилась, затем увеличилась.
Б) Уменьшилась.
В) Увеличилась.
Г) Вначале увеличилась, затем уменьшилась.
Д) Не изменилась.
66. Внутренняя энергия газа при переходе из состояния 1 в состояние 2:
А) Вначале уменьшилась, затем увеличилась.
Б) Уменьшилась.
В) Не изменилась.
Г) Вначале увеличилась, затем уменьшилась.
Д) Увеличилась.
67. Внутренняя энергия идеального газа при увеличении его давления в 2 раза и уменьшении занимаемого объема в 2 раза:
А) Уменьшится в 2 раза.
Б) Увеличится в 2 раза.
В) Увеличится в 4 раза.
Г) Не изменится
Д) Уменьшится в 4 раза.
68. На сколько увеличится внутренняя энергия трёх молей идеального одноатомного газа при изобарном нагревании его от 299 К до 301 К?
А) 50 Дж.
Б) 33 Дж.
В) 75 Дж
Г) 25 Дж.
Д) 125 Дж.
69. Определить внутреннюю энергию 5 кг аммиака NH3 при температуре 340 К:
А) 4 ⋅ 105Дж.
Б) 2,5 ⋅ 107Дж.
В) 28,51 ⋅ 105Дж.
Г) 24,93 · 10Дж.
Д) 5 ⋅ 105Дж.
70. На сколько увеличится внутренняя энергия трех молей идеального двухатомного газа при изохорном нагревании его от 190С до 210С:
А) 360 Дж.
Б) 200 Дж.
В) 100 Дж.
Г) 187 Дж.
Д) 124,5 Дж.
71. Внутренняя энергия газа не изменяется при процессе:
А) Любом.
Б) Изотермическом.
В) Изохорном.
Г) Изобарном.
Д) Адиабатном.
72. Функция распределения молекул идеального газа по скоростям найдена:
А) Больцманом.
Б) Клаузиусом.
В) Карно.
Г) Максвеллом.
Д) Эйнштейном.
73. Чему равно отношение средней квадратичной скорости молекул газа к наиболее вероятной скорости?
А)
Б) .
В) .
Г) .
