Вытеснение воздуха из сосуда
КОНКУРС “Я ИДУ НА
УРОК”
ПРАКТИЧЕСКАЯ РАБОТА (1 ч) 8 КЛАСС
Работа проводится учащимися
самостоятельно под контролем учителя.
Предлагаю результат моей многолетней работы по
подготовке и проведению практических работ в
общеобразовательной школе на уроках химии в 8–9-х
классах:
- «Получение и свойства
кислорода», - «Приготовление
растворов солей с определенной массовой долей
растворенного вещества», - «Обобщение сведений о
важнейших классах неорганических соединений», - «Электролитическая
диссоциация», - «Подгруппа кислорода»
(см. след. номера газеты «Химия»).
Все они апробированы мною на занятиях. Их
можно использовать при изучении школьного курса
химии как по новой программе О.С.Габриеляна, так и
по программе Г.Е.Рудзитиса, Ф.Г.Фельдмана.
Ученический эксперимент – это вид
самостоятельной работы. Эксперимент не только
обогащает учащихся новыми понятиями, умениями,
навыками, но и является способом проверки
истинности приобретенных ими знаний,
способствует более глубокому пониманию
материала, усвоению знаний. Он позволяет более
полно осуществлять принцип вариативности
восприятия окружающего мира, т. к. главная
сущность этого принципа – связь с жизнью, с
будущей практической деятельностью учащихся.
Цели. Уметь получать кислород в
лаборатории и собирать его двумя методами:
вытеснением воздуха и вытеснением воды;
подтвердить опытным путем свойства кислорода;
знать правила техники безопасности.
Оборудование. Металлический штатив с
лапкой, спиртовка, спички, пробирка с
газоотводной трубкой, пробирка, комочек ваты,
пипетка, химический стакан, лучинка,
препаровальная игла (или проволока),
кристаллизатор с водой, две конические колбы с
пробками.
Реактивы. KMnO4 кристаллический (5–6
г), известковая вода Сa(OH)2, древесный уголь,
Fe (стальная проволока или скрепка).
Правила техники безопасности.
Осторожно обращайтесь с химическим
оборудованием!
Помните! Пробирку прогревают, держа ее в
наклонном положении, по всей длине двумя-тремя
движениями в пламени спиртовки. При нагревании
направляйте отверстие пробирки в сторону от себя
и соседей.
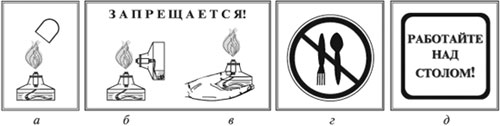 |
Тушите спиртовку только колпачком (а). |
Предварительно учащиеся получают
домашнее задание, связанное с изучением
содержания предстоящей работы по инструкции,
одновременно используя материалы учебников 8-го
класса авторов О.С.Габриеляна (§ 14, 40) или
Г.Е.Рудзитиса, Ф.Г.Фельдмана (§ 19, 20). В тетрадях для
практических работ записывают название темы,
цель, перечисляют оборудование и реактивы,
оформляют таблицу для отчета.
ХОД УРОКА
Один опыт я ставлю выше,
чем тысячу мнений,
рожденных только
воображением.
М.В.Ломоносов
1. Перманганат калия (КMnO4) поместите в
сухую пробирку. У отверстия пробирки положите
рыхлый комочек ваты.
2. Закройте пробирку пробкой с газоотводной
трубкой, проверьте на герметичность (рис. 1).
Рис. 1. |
(Пояснения учителя, как проверить
прибор на герметичность.) Укрепите прибор в лапке
штатива.
3. Газоотводную трубку опустите в стакан, не
касаясь дна, на расстоянии 2–3 мм (рис. 2).
Рис. 2. |
4. Подогрейте вещество в пробирке.
(Помните правила техники безопасности.)
5. Проверьте наличие газа тлеющей лучинкой
(угольком). Что наблюдаете? Почему кислород можно
собирать методом вытеснения воздуха?
6. Соберите полученный кислород в две колбы для
проведения следующих опытов. Колбы закройте
пробками.
7. Оформите отчет, пользуясь табл. 1, которую
разместите на развороте тетради.
1. Пробирку заполните водой. Закройте пробирку
большим пальцем и переверните ее вверх дном. В
таком положении опустите руку с пробиркой в
кристаллизатор с водой. Подведите к концу
газоотводной трубки пробирку, не вынимая ее из
воды (рис. 3).
Рис. 3. |
2. Когда кислород вытеснит воду из
пробирки, закройте ее большим пальцем и выньте из
воды. Почему кислород можно собирать способом
вытеснения воды?
Внимание! Выньте газоотводную трубку из
кристаллизатора, не прекращая нагревать
пробирку с КMnО4. Если этого не сделать, то
воду перебросит в горячую пробирку. Почему?
1. Закрепите уголек на металлической проволоке
(препаровальной игле) и внесите в пламя
спиртовки.
2. Раскаленный уголек опустите в колбу с
кислородом. Что наблюдаете? Дайте объяснение
(рис. 4).
Рис. 4. |
3. После извлечения несгоревшего угля
из колбы, прилейте в нее 5–6 капель известковой
воды
Са(ОН)2. Что наблюдаете? Дайте объяснение.
4. Оформите отчет о работе в табл. 1.
1. Прикрепите к одному концу стальной проволоки
кусочек спички. Зажгите спичку. Проволоку с
горящей спичкой опустите в колбу с кислородом.
Что наблюдаете? Дайте объяснение (рис. 5).
Рис. 5. |
2. Оформите отчет о работе в табл. 1.
Таблица 1
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | |||
| Получение кислорода из KMnО4 при нагревании | |||
| Доказательство получения кислорода c помощью тлеющей лучинки | |||
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха, вытеснением воды | |||
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля, горение железа (стальная проволока, скрепка) |
Сделайте
письменный общий вывод о проделанной работе (5
мин).
ВЫВОД. Один из способов получения
кислорода в лаборатории – разложение КMnO4.
Кислород – газ без цвета и запаха, тяжелее
воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.)
= 29, из чего следует 32/29 1,103),
малорастворим в воде. Вступает в реакции с
простыми веществами, образуя оксиды.
Приведите рабочее место
в порядок (3 мин): разберите прибор, расставьте
посуду и принадлежности на свои места.
Сдайте тетради на
проверку.
Домашнее задание.
Задача. Определите, какое из соединений
железа – Fe2О3 или Fe3О4 –
богаче железом?
| Дано: | Найти: |
| Fe2O3, Fe3O4. | (Fe) в Fe2O3, ‘(Fe) в Fe3O4 |
Решение
(Х) = n•Ar(X)/Mr,
где n – число атомов элемента Х в формуле
вещества.
Mr(Fe2O3) = 56•2 + 16•3 = 160,
(Fe) = 56•2/160 = 0,7,
(Fe) = 70%,
Mr (Fe3O4) = 56•3 + 16•4 = 232,
‘(Fe)
= 56•3/232 = 0,724,
‘(Fe) = 72,4%.
Ответ. Fe3O4 богаче железом, чем Fe2O3.
Учитель во время практической работы наблюдает
за правильностью выполнения приемов и операций
учащимися и отмечает в карточке учета умений
(табл. 2).
Таблица 2
Карточка учета умений
| Операции практической работы | Фамилии учащихся | |||||
|---|---|---|---|---|---|---|
| А | Б | В | Г | Д | Е | |
| Сборка прибора для получения кислорода | ||||||
| Проверка прибора на герметичность | ||||||
| Укрепление пробирки в лапке штатива | ||||||
| Обращение со спиртовкой | ||||||
| Нагревание пробирки с KМnО4 | ||||||
| Проверка выделения О2 | ||||||
| Собирание О2 в сосуд двумя методами: вытеснением воздуха, вытеснением воды | ||||||
| Сжигание угля | ||||||
| Сжигание Fe (стальной проволоки) | ||||||
| Kультура выполнения опытов | ||||||
| Оформление работы в тетради | ||||||
Образец отчета о проделанной практической
работе (табл. 1)
| Выполняемые операции (что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения. Условия проведения реакций. Уравнения реакций | Объяснения наблюдений. Выводы |
|---|---|---|---|
| Сборка прибора для получения кислорода. Проверка прибора на герметичность | Выделяются пузырьки воздуха | Прибор собран герметично | |
| Получение кислорода из KMnO4 при нагревании | При нагревании KMnO4 происходит реакция: | О2 получают в лаборатории разложением KMnO4 при нагревании | |
| Доказательство получения кислорода при помощи тлеющей лучинки | Тлеющая лучинка (уголь) ярко загорается в О2 | Полученный газ О2 поддерживает горение | |
| Характеристика физических свойств О2. Собирание О2 двумя методами: вытеснением воздуха (а), вытеснением воды (б) | Kислород вытесняет воздух и воду из сосудов | Kислород – газ без цвета и запаха, немного тяжелее воздуха, поэтому его собирают в сосуд, поставленный на дно. Kислород малорастворим в воде | |
| Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля (a), горение железа (стальная проволока, скрепка, стружка) (б) | Раскаленный уголек ярко горит в О2: Известковая вода мутнеет, т. к. | О2 взаимодействует с простыми веществами – металлами и неметаллами. Образование осадка белого цвета подтверждает наличие в колбе СО2 |
О.М.БЫКОВА,
учитель химии
Красноярской средней школы № 2
(с. Красный Яр, Астраханская обл.)
Источник
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Демонстрационный эксперимент и многие
практические работы основаны на использовании
простых химических приборов. Кроме знакомства с
химическими превращениями веществ, учащиеся
должны разобраться в физической сущности того,
что происходит, и уметь по рисунку прибора
объяснить суть происходящего: что куда движется
и что где происходит.
Один из приборов в кабинете химии – газометр.
На рис. 1 изображен газометр, наполненный газом.
Это может быть кислород, как указано на рисунке,
углекислый газ или просто воздух. Краны 1 и 2
в этот момент закрыты. Газ в соответствии с
законом Паскаля оказывает давление на стенки
сосуда и воду. Открываем кран 1, столб воды из
воронки оказывает давление на газ, поджимая его,
но т.к. внутреннее давление газа и давление воды
уравновешены, ничего не происходит. Открываем
кран 2, газ устремляется в выходное отверстие
(скорость потока регулируется осторожным
поворотом крана). Давление внутри сосуда падает
– и вода из воронки поступает в газометр. После
закрытия крана 2 отбор газа прекращается,
уровень воды устанавливается на более высокой
отметке, т.к. наступает новое равновесие сил. Для
прекращения давления воды перекрывается кран 1.
Рис. 1. |
Второй прибор, сходный с газометром, –
аппарат Киппа (рис. 2). В этом приборе можно
получать водород из цинка и соляной кислоты (см.
рис. 2), сероводород из сернистого железа,
углекислый газ из мрамора. В позиции а прибор
находится в рабочем состоянии, кран открыт.
Крепкий раствор соляной кислоты устремляется в
нижнюю часть прибора, заполняет его и смачивает
металлический цинк, лежащий на медной сетке. Цинк
растворяется в кислоте, реагирует с ней,
образующийся водород устремляется в среднюю
сферу прибора, вытесняет воздух, смешиваясь с
ним. Поэтому выходящий газ надо проверить на
чистоту. Распределение физических сил в приборе
показано на рис. 2 при помощи стрелок.
Рис. 2. |
Закрываем кран. Водород продолжает
образовываться, его количество увеличивается.
Поскольку выход газу перекрыт, внутри сферы
увеличивается давление. Оно и выдавливает
кислоту из средней сферы до тех пор, пока кислота
перестанет покрывать поверхность цинка.
Химическая реакция прекращается (смоченный
кислотой цинк продолжает некоторое время
реагировать с ней). Внутреннее давление в
приборе, создаваемое водородом, и давление,
создаваемое гидравлическим затвором,
уравновешиваются.
Рассмотрим методы собирания газов. На рис. 3
показано, как собирать газ методом вытеснения
воздуха. Если газ токсичный, эта операция
проводится в вытяжном шкафу. Газы, которые
тяжелее воздуха, – СО2, О2, HCl, SO2,
поступая в банку или химический стакан,
вытесняют воздух.
Рис. 3. |
При изучении углекислого газа: его
физических свойств и неспособности поддерживать
горение органических веществ – демонстрируется
занимательный опыт гашения горящей на воздухе
парафиновой свечи (рис. 4). Углекислый газ, как
более тяжелый, под действием силы тяжести
опускается вниз. Он заполняет емкость и
вытесняет воздух, который в ней содержится. Свеча
в атмосфере углекислого газа гаснет.
Рис. 4. |
Прибор, изображенный на рис. 5, учащиеся
собирают на практической работе «Получение
кислорода и изучение его свойств». Этот прибор
иллюстрирует метод собирания газа путем
вытеснения воздуха (физическое обоснование
понятия «относительная плотность»).
Рис. 5. |
Другой способ собирания газов связан с
вытеснением воды из сосуда. Таким путем можно
собирать газы, мало растворяющиеся в воде, в
частности оксид азота(II) (рис. 6). Газ из реактора 1
поступает в газоотводную трубку 2,
подведенную под перевернутый вверх дном цилиндр 3.
Проходя через толщу воды, газ собирается в зоне
дна цилиндра. Под давлением газа вода
выталкивается из цилиндра.
Если газ плохо растворяется в воде, то этим
газом мож
Рис. 6. |
но насыщать воду, как показано на рис. 7.
В таком приборе можно получать хлор (см. рис. 7) или
сернистый газ, добавляя к кристаллам сульфита
натрия концентрированную серную кислоту. Газ,
получаемый в колбе Вюрца, поступает в
газоотводную трубку, концом погруженную в воду.
Частично газ растворяется в воде, частично
заполняет пространство над водой, вытесняя
воздух.
Рис. 7. |
Если газ хорошо растворяется в воде, то
его нельзя собирать методом вытеснения воды. На
рис. 8 и 9 показано, как собирают хлороводород и
аммиак методом вытеснения воздуха. На тех же рис.
8 и 9
(cм. c. 22) изображено растворение газов при
погружении пробирок с HCl и NH3 отверстием в
воду.
Рис. 8. | Рис. 9. |
Если насыщать хлороводородом из
пробирки (с реагентами) с газоотводной трубкой,
опущенной в воду (рис. 10), то первые порции газа
мгновенно растворяются в воде. В 1 л воды
растворяется около 500 л хлороводорода,
следовательно, поступающий газ не создает
избыточного давления. На рис. 10 отмечено
последовательное изменение давления газа pвнутр
в реакционной пробирке по отношению к
атмосферному давлению pатм. Давление
внутри прибора становится меньше внешнего
давления, и вода стремительно заполняет
газоотводную трубку и сам прибор. Кроме того, что
эксперимент испорчен, еще и пробирка может
треснуть.
Рис. 10. |
При изучении химических свойств
металлического натрия (рис. 11) важно не только
наблюдать его поведение в реакции с водой, но и
объяснять наблюдаемые явления. Первое
наблюдение – натрий остается на поверхности
воды, следовательно, его плотность меньше
единицы (плотность воды). Второе наблюдение –
натрий «мечется» по воде по причине
отталкивающего действия выделяющегося газа.
Третье наблюдение – натрий плавится и
превращается в шарик. Реакция взаимодействия
натрия с водой – экзотермическая. Выделяющейся
теплоты достаточно, чтобы расплавить натрий,
следовательно, он – легкоплавкий металл.
Четвертое наблюдение – реакция сопровождается
вспышками, следовательно, теплоты реакции
достаточно и для самовозгорания натрия, и для
микровзрыва водорода. Если реакцию проводить в
узком пространстве (в пробирке), да еще и с
крупным кусочком натрия, то взрыва водорода не
избежать. Чтобы не было взрыва, реакцию проводят
в кристаллизаторе или в большом по диаметру
химическом стакане и с использованием
маленького кусочка натрия.
Рис. 11. |
Необходимо уделить большое внимание
правилу растворения концентрированной серной
кислоты в воде (рис. 12). Кислота, как более тяжелая
жидкость, устремляется на дно круглодонной
колбы. Все остальное показано на рис. 12.
Рис. 12. |
Формированию физико-химического
мышления способствует изучение кислорода (как в
начальном курсе химии, так и в курсе органической
химии). Речь идет об использовании кислорода и
ацетилена при сварке и автогенной резке металла
(рис. 13). При сварке высокотемпературное пламя
горящего в кислороде ацетилена (до 2500 °С)
направляется на металлический провод и
свариваемое место. Металл плавится, получается
шов. При автогенной резке пламя подплавляет
металл, а избыток кислорода его выжигает.
Рис. 13. |
Не в каждом кабинете химии имеется
кремний как простое вещество. Проверим его на
электропроводность при помощи простейшего
прибора: щуп с упругими удлиненными железными
концами, лампочка (смонтированная на подставке),
и электропровод с вилкой (рис. 14). Лампочка
светится, но не ярко – видно, что кремний
проводит электрический ток, но оказывает ему
значительное сопротивление.
Рис. 14. |
Химический элемент кремний – аналог
углерода, но радиус его атомов больше, чем радиус
атомов углерода. Кремний, как простое вещество,
имеет такую же (как алмаз) кристаллическую
решетку (атомную) с тетраэдрической
направленностью химических связей. В алмазе
ковалентные связи прочные, он не проводит
электрический ток. В кремнии, как показывает даже
грубый эксперимент, какая-то часть электронных
пар распаривается, что обусловливает некоторую
электропроводность вещества. Кроме того, кремний
разогревается (у некоторых учащихся есть
возможность в этом убедиться), что тоже
свидетельствует о сопротивлении вещества
электрическому току.
С большим интересом учащиеся наблюдают за
исследованием физических и химических свойств
бензола (рис. 15). К небольшому количеству воды
приливаем слой бензола толщиной ~2 мм (см. рис. 15,
а). Видно, что две бесцветные жидкости не
смешиваются. Интенсивным встряхиванием
перемешиваем эту расслоенную смесь, получаем
«седую» эмульсию. Фиксируем пробирку в
вертикальном положении. Учащиеся наблюдают
постепенное расслоение бензола и воды, причем
сначала прозрачным становится нижний уровень
содержимого, и через непродолжительное время
получаем исходное распределение. Молекулы воды
легче молекул бензола, но ее плотность несколько
больше. Взаимодействие между неполярными
молекулами бензола и полярными молекулами воды
незначительное, очень слабое, поэтому большая
часть бензола выталкивается на поверхность воды
(см. рис. 15, б).
Рис. 15. |
Теперь приливаем бензол к нескольким
миллилитрам бромной воды (небольшой
интенсивности окрашивания) (см. рис. 15, б).
Жидкости не смешиваются. Интенсивно
перемешиваем содержимое пробирки и даем
возможность системе отстояться. Бром, прежде
растворенный в воде, экстрагируется в слой
бензола, что видно по изменению окраски и
увеличению ее интенсивности.
К содержимому пробирки прильем несколько
миллилитров слабого раствора щелочи
(см. рис. 15, б). Бром вступает в реакцию со
щелочью. Слой бензола обесцвечивается, а
образовавшиеся неорганические вещества и вода
переходят в нижний (водный) слой.
В данной статье мы ограничились примерами,
которые иллюстрируют не просто связь
преподавания химии с физикой, а компенсируют
недостаток учебников, в которых названные
физические явления, как правило, не находят
отражения.
Е.Г.Шмуклер,
заслуженный учитель Украины
(г. Славута, Украина)
Источник
