Взаимодействием молекул газа между собой и со стенками сосуда
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
- все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
- частицы находятся в непрерывном тепловом движении;
- между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма – частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Объем газа обозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м3.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
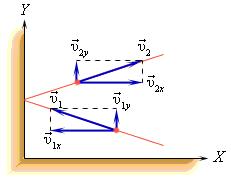
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.
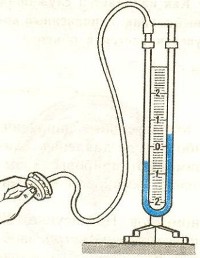
Жидкостные манометры:
- открытый – для измерения небольших давлений выше атмосферного
- закрытый – для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума

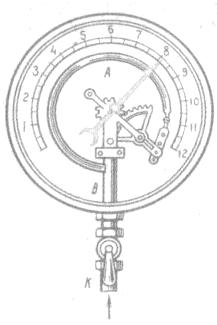
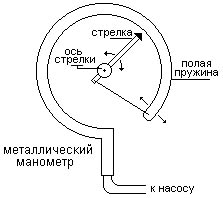
Металлический манометр – для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
Основное уравнение молекулярно-кинетической теории идеального газа.
Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
p = 1/3·m0·n·v2
m0 – масса одной молекулы газа;
n = N/V – число молекул в единице объема, или концентрация молекул;
v2 – средняя квадратичная скорость движения молекул.
Так как средняя кинетическая энергия поступательного движения молекул E = m0*v2/2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v2)/2 = 2/3·E·n
p = 2/3·E·n
Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v2
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
p = nkT
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим или
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
Уравнение Клайперона можно записать в другой форме.
p = nkT,
учитывая, что
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
Соотношение
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pSΔh = R
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Таким образом, R = A.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Источник
Метод описания свойств сложных объектов, например термодинамических систем, через свойства элементарных их составляющих, был впервые использован в древней Греции. Этот метод применяется в механике, где в качестве элементарного объекта используется материальная точка. При описании различных веществ в качестве их элементарных составляющих древними греками было введено понятие атома, которое происходит от греческого слова, означающего неделимый. В физике нашли широкое применение такие элементарные объекты как точечные заряды, ядра, элементарные частицы, кварки и т.д.
В молекулярно-кинетической теории материи элементарным объектом является молекула – мельчайшая частица вещества, отражающая его физико-химические свойства.
Основное положение молекулярно-кинетической теории заключается в том, что вещество состоит из мельчайших частиц – молекул. Все молекулы находятся в постоянном беспорядочном движении, при котором они обмениваются импульсами и энергией.
Молекулярно-кинетическая теория развивалась параллельно с термодинамикой, и зачастую эти теории разрабатывались одними и теми же исследователями. При этом молекулярно-кинетическая теория позволяла получить обоснование термодинамических законов и более глубоко объяснить их физическую сущность.
Проведем рассмотрение свойств идеального газа с использованием молекулярно-кинетической теории. С точки зрения этой теории идеальным газом называется газ, молекулы которого являются материальными точками, то есть расстояния между молекулами намного превосходят их размеры, а единственный вид их взаимодействий между собой – упругие механические столкновения. При этом считается, что молекулы этого газа гораздо чаще сталкиваются между собой, чем со стенками сосуда.
Очевидно, что сформулированные выше требования выполняются для достаточно (но не очень сильно) разреженных газов, молекулы которых не вступают в химические взаимодействия между собой.
Далее будем предполагать, что рассматриваемый газ находится в состоянии термодинамического равновесия со стенками сосуда, и взаимодействие его молекул со стенками описывается моделью упругих соударений с зеркальным отражением.
Покажем, что молекулярно-кинетическая теория позволяет получить для идеального газа закон Бойля-Мариотта и сделать вывод о связи кинетической энергии его молекул с температурой газа. Рассмотрим сосуд в виде куба с ребром длиной , а оси координат , и направим параллельно трем граням куба (см. рис. 2.1).
Рис. 2.1. |
Если молекула массой , имеющая составляющую скорости (на рис. 2.1 индекс при скоростях опущен) вдоль оси , сталкивается со стенкой сосуда, расположенной в плоскости , то этой стенке будем передан импульс:
| . | (2.15) |
Считая, что молекула, летящая вдоль оси , не испытывает соударений с другими молекулами газа, оценим промежуток времени между очередными соударениями этой молекулы со стенкой сосуда, после её переотражения от противоположной его стенки:
| . | (2.16) |
Полученное выражение применимо и для более общего случая, так как при упругом соударении рассматриваемой молекулы с другими стенками сосуда, например со стенкой, расположенной в плоскости , составляющая её скорости вдоль оси не изменяется, а при упругом соударении двух одинаковых молекул происходит обмен их скоростями (см. рис. 2.1).
Тогда силу и давление , действующие со стороны рассматриваемой молекулы на стенку сосуда, расположенную в плоскости , можно оценить по следующим формулам:
| , | (2.17) |
| , | (2.18) |
где: – объем, занимаемый газом внутри сосуда.
Рассуждая аналогичным образом, величины давлений, действующих со стороны молекулы на стенки, лежащие в плоскостях и , можно определить с помощью формул:
| , | (2.19) |
| . | (2.20) |
Предполагая газ изотропным, можно считать, что значения величин давлений на различные стенки сосуда в среднем одинаковы:
| . | (2.21) |
Тогда имеем:
| , | (2.22) |
где: – значение квадрата скорости i-ой молекулы.
Выражение (2.22) позволяет получить зависимость между давлением и кинетической энергией для i-ой молекулы:
| . | (2.23) |
Для нахождения уравнения для полного давления необходимо просуммировать выражение (2.23) по всем молекулам газа:
| , | (2.24) |
где: – полное число молекул, – суммарная кинетическая энергия поступательного движения всех молекул газа.
Если суммарная кинетическая энергия идеального газа постоянна: , то на основании выражения (2.24) можно записать уравнение
| , | (2.25) |
полностью совпадающие с выражением (2.11), описывающим закон Бойля-Мариотта (2.11)
Сравнение выражения (2.24) с уравнением Клапейрона-Менделеева (2.2) позволяет сделать вывод, что для идеального газа кинетическая энергия поступательного движения его молекул пропорциональна абсолютной температуре этого газа:
| . | (2.26) |
Для одного моля газа имеем:
| . | (2.27) |
Полученные выражения позволяют утверждать, что абсолютная температура идеального газа есть мера кинетической энергии поступательного движения его молекул. Поскольку у идеального газа отсутствует потенциальная энергия взаимодействия молекул между собой, то их суммарную кинетическую энергию можно считать равной внутренней энергии идеального газа. Поэтому, температура является также мерой внутренней энергии идеального газа в состоянии термодинамического равновесия.
Среднюю кинетическую энергию поступательного движения одной молекулы газа можно найти как отношение суммарной кинетической энергии молекул , содержащихся в одном моле газа, к постоянной Авогадро , численно равной количеству этих молекул:
| . | (2.28) |
Или, если ввести новую постоянную:
| , | (2.29) |
которая в честь австрийского физика-теоретика Людвига Больцмана (1844 – 1909) получила название постоянной Больцмана, имеем
| . | (2.30) |
С помощью выражения (2.29) уравнение Клапейрона-Менделеева (2.2) может быть преобразовано к виду:
| , | (2.31) |
где суммарное число молекул газа равно: . Деление этого выражения на объем газа позволяет получить уравнение для давления, часто называемое основным уравнением молекулярно-кинетической теории:
| , | (2.32) |
или с использованием формулы (2.30)
| . | (2.33) |
Здесь: – концентрация молекул газа.
Считая все молекулы газа одинаковыми и имеющими массу , определим с помощью формулы (2.30)средний квадрат скорости молекул газа
| (2.34) |
и их среднюю квадратичную скорость
| . | (2.35) |
В соответствие с формулами (2.8) и (2.29) постоянную Больцмана можно представить в виде:
| . | (2.36) |
Тогда выражение (2.35) для средней квадратичной скорости можно записать в форме:
| . | (2.37) |
Уравнение (2.32) позволяет определить давление смеси газов. Из него следует, что давление, создаваемое идеальным газом, не зависит от физико-химических свойств молекул, образующих газ. Считая газы находящимися в равновесном состоянии, концентрацию молекул в смеси можно представить как сумму концентраций молекул всех газов, входящих в смесь:
| . | (2.38) |
Тогда на основании выражения (2.32) имеем
| . | (2.39) |
Формула (2.39) описывает закон, открытый Джоном Дальтоном (1716 – 1844), который заключатся в равенстве давления, создаваемого смесью газов, сумме давлений всех газов, составляющих эту смесь. Из этого закона следует, что в равновесном состоянии на характер взаимодействия одного газа из смеси со стенками сосуда не оказывает влияние присутствие других газов.
До сих пор мы рассматривали модель идеального газа, молекулы которого считались материальными точками, то есть одноатомный газ. Для таких молекул число их степеней свободы, в соответствии с классической механикой, равняется количеству координат, необходимому для задания их положения в пространстве. Очевидно, что число степеней свободы в этом случае равно трем.
Однако молекула газа не обязательно должна состоять из одного атома, который считается материальной точкой. Газ может быть двухатомным, трёхатомным и т. д. Для молекул таких газов характерно наличие внутренней структуры и, соответственно, дополнительных степеней свободы. Если атомы в молекуле жестко связаны между собой, в качестве дополнительных степеней свободы выступают вращательные степени, характеризующие угловое положение молекулы в пространстве. В этом случае двухатомные молекулы имеют дополнительно две вращательные степени свободы, так как учет вращения вокруг оси, соединяющей атомы, считающиеся материальными точками, не имеет смысла. Следовательно, для такой молекулы общее число её степеней свободы равно пяти. Для молекул, состоящих из трех и белее жестко связанных атомов число дополнительных вращательных степеней свободы равно трем, а суммарное число степеней свободы – соответственно шести.
Если атомы в молекуле связаны не жесткой, а упругой связью, то кроме вращательных, появляются еще и колебательные степени свободы, наличие которых необходимо учитывать при описании свойств многоатомного газа, состоящего из таких молекул.
В одноатомном газе молекула имеет три степени свободы, соответствующие трем пространственным координатам. Вследствие равноправности этих координат, можно, на основании выражения (2.30), сделать предположение, что на каждую степень свободы молекулы одноатомного газа приходится в среднем кинетическая энергия, равная .
В случае многоатомного газа распределение энергии по степеням свободы его молекул подчиняется закону равнораспределения энергии, который гласит: средняя кинетическая энергия, приходящаяся при тепловом равновесии на одну степень свободы молекулы равна .
Таким образом, в самом общем случае для определения суммарной кинетической энергии всех молекул газа необходимо вместо выражения (2.26) использовать формулу:
| (2.40) |
или
| , | (2.41) |
а для нахождения кинетической энергии одной молекулы – соответственно вместо (2.30) надо применять следующее выражение:
| . | (2.42) |
Здесь: – число степеней свобода молекулы газа.
Для одноатомного газа , а для газа, молекулы которого состоят из двух жестко связанных атомов . Соответственно для газов из жестких, многоатомных молекул .
Отметим, что непосредственное использование выражений (2.41) и (2.42) для многоатомных газов, в молекуле которых атомы связаны не жестко, не является корректным. Это объясняется тем, что колебательные степени свободы обладают при нормальных условиях значительно меньшей, в сравнение с , энергией. Только при достаточно высокой температуре, порядка 103 К, энергия колебательных степеней свободы становится сравнима с . При низких температурах (порядка 10 К) закон равнораспределения становится не применим и для вращательных степеней свободы. Это связано с тем, что законы классической статистической механики, на которых основано доказательство закона о равнораспределении энергии по степеням свободы, имеют весьма ограниченное применение для атомно-молекулярных систем. Здесь необходимо применение квантовомеханических законов.
Однако для газов, находящихся при нормальных условиях, закон равнораспределения может быть применён для поступательных и вращательных степеней свободы с достаточно высокой степенью точности. Этим объясняется широкое использование при практических расчетах молекулярно-кинетической теории.
При расчете энергии многоатомных молекул с колебательными степенями свободы необходимо, кроме кинетической энергии атомов в молекуле, учитывать потенциальную энергию взаимодействия этих атомов. Если для описания колебаний атомов в молекуле применима модель гармонического осциллятора, что, как показывает опыт, оправдано, то среднюю потенциальную энергию атомов можно считать равной их средней кинетической энергии. Тогда полную энергию, приходящуюся на одну колебательную степень свободы, можно считать равной удвоенной её кинетической энергии. Поэтому при учете колебательных степеней свободы необходимо энергию молекулы увеличивать на величину на каждую колебательную степень свободы. Этим отличается учет колебательных степеней свободы от учета степеней свободы, связанных с поступательным и вращательным движением, где на каждую степень свободы приходится энергия, равная .
Проведем теперь оценки длины свободного пробега молекул газа. Эта величина численно равна среднему расстоянию, которое пролетает молекула между очередными её столкновениями с другими молекулами газа.
Условие, что молекулы идеального газа должны гораздо чаще претерпевать взаимные столкновения по сравнению с соударениями со стенками, соответствует случаю, когда размеры сосуда существенно превышают длину свободного пробега молекул.
Для оценки длины свободного пробега молекул идеального газа, воспользуемся следующей простейшей молекулярно-кинетической моделью. Будем считать, что молекулы идеального газа представляют собой твёрдые шары, диаметром , которые взаимодействуют друг с другом только путём упругих соударений при непосредственном соприкосновении. Рассмотрим взаимодействие двух молекул, причём систему отсчёта свяжем с центром молекулы 1, расположенной слева (см. рис. 2.2).
Рис. 2.2. |
Пусть молекула 2 движется со скоростью в этой системе отсчёта и проходит расстояние с момента предыдущего столкновения до столкновения с молекулой 1. Для выполнения этого условия внутри цилиндра с основанием площадью и длиной не должно быть ни одной другой молекулы газа, кроме молекулы 1. Это условие требует уточнения. Поскольку мы аппроксимируем форму молекулы как шаровую с диаметром , то молекула 2 не испытает ни одного столкновения с другими молекулами, если внутри рассматриваемого цилиндра не будет ни одного их центра. Из этого следует, что на одну молекулу газа в среднем приходится объем величиной
| . | (2.43) |
Так как концентрацию молекул газа можно представить в виде
| , | (2.44) |
то отсюда следует выражение для среднего значения величины :
| . | (2.45) |
Если в лабораторной системе отсчёта средняя скорость молекул равна , то длина свободного пробега и величина будут связаны соотношением
| , | (2.46) |
где: – среднее значение относительной скорости молекулы 2 в системе отсчёта, связанной с молекулой 1.
По правилу сложения векторов, величину относительной скорости можно определить по формуле:
| , | (2.47) |
где: и – скорости 1 и 2 молекул, – угол между направлениями векторов этих скоростей. Так как скорости молекул могут иметь любые произвольные направления, а средние значения их величин в равновесном газе одинаковые, то усреднение соотношения (2.47) по всем возможным углам ( дает
| . | (2.48) |
Соотношение (2.48) позволяет, считая, что средние квадраты скоростей молекул пропорциональны квадратам средних значений этих скоростей, записать следующее соотношение:
| . | (2.49) |
Тогда выражение для длины свободного пробега принимает форму
| . | (2.50) |
Из этой формулы следует обратная пропорциональная зависимость длины свободного пробега молекулы идеального газа от его концентрации .
Часто вместо величины , характеризующей размер молекулы, используется величина
| , | (2.51) |
которая называется эффективным сечением взаимодействия молекулы. Тогда формула (2.50) принимает вид:
| . | (2.52) |
Определим также среднюю частоту соударений молекулы газа с другими молекулами. Эта величина равна отношению средней скорости молекулы к длине её свободного пробега:
| , | (2.53) |
или с учетом выражения (2.52):
| . | (2.54) |
В заключении отметим, что полученные формулы справедливы с точностью до безразмерного множителя, величина которого порядка единицы. Но это не имеет принципиального значения, так как размер молекулы , и, следовательно, её эффективное сечение , не могут быть точно определены с помощью независимых измерений. Измеренные значения этих величин достаточно сильно отличаются при применении различных способов их определения.
Источник
