Закладка сердца и магистральных сосудов

Развитие сердца у плода. Закладка сердечной трубки у эмбриона
Сердце первоначально имеет парную закладку, оно появляется у человека в той стадии развития, когда зародыш еще распростерт в плоскости. В это время сердце представляет собой парно заложенный большой сосуд. У животных с меньшим содержанием желтка в яйце (у земноводных и у низших рыб) сердце с самого начала закладывается в виде единой эндотелиальной трубки.
Однако в тех случаях, когда зародыш развивается из плоского зародышевого щитка, закладка сердца в связи с большим количеством желтка в яйце (у высших рыб, пресмыкающихся и, наконец, у млекопитающих) должна быть двойной, ее слияние в единую сердечную трубку происходит вторично.
Основой сердца у человека является область так называемой кардиогенной пластинки, которая наблюдается уже у распростертых в плоскости зародышей под краниальным, головным концом тела эмбриона в сгущенной мезодерме спланхноплевры. Сначала дорсальнее этой пластинки возникает несколько щелей неправильной формы, которые со временем сливаются в непрерывную единую полость закладки будущей перикардиальной (околосердечной) полости.
Она вообще является первой частью закладывающейся эмбриональной полости тела. Область кардиогенной пластинки и закладок околосердечной полости, расположенных по обеим сторонам тела, после обособления краниального конца зародыша от окружающей среды перемещается, как это уже описывалось выше, на его вентральную сторону, располагаясь затем вентральиее головной кишки.
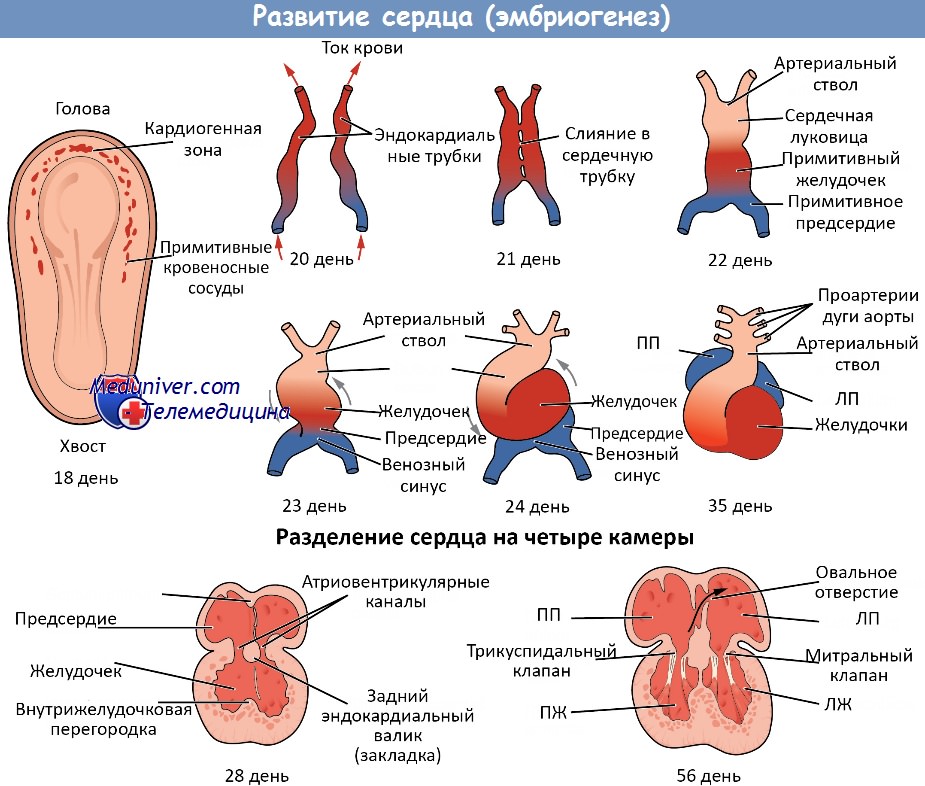
При этом закладка сердца поворачивается таким образом, что ее отделы, лежащие сначала краниально, оказываются расположенными каудально, а закладка околосердечной полости перемещается вентральнее закладки сердца.
Первой закладкой сердечной трубки является совокупность сгущенных мезенхимных клеток, лежащих в области кардиогенной пластинки. Эти клетки по обеим сторонам тела распределяются в две продольно проходящие полоски, в которых впоследствии возникают просветы; таким образом, возникают две идущие продольно и латерально эндотелиальные трубки, располагающиеся по обеим сторонам головной кишки в двух складках мезенхимы, выпячивающихся в закладку околосердечной полости.
По мере сближения обеих закладок между собой обе трубки по средней линии постепенно сливаются друг с другом, образуя единую сердечную трубку, причем слияние сначала происходит в более краниально расположенной области. При этом их мезенхимная оболочка также сливается в единую, так называемую миоэпикардиальную трубку, которая является зачатком для сердечных мышц и эпикардия. Сначала каудальные отделы сердечной трубки еще не соединены.
Они являются двойными и представляют собой закладки обоих будущих предсердий. В процессе слияния обе закладки околосердечной полости сливаются в единую перикардиальную полость. Первичная сердечная трубка в этой полости прикрепляется к ее задней стенке посредством двойной складки мезенхимы, которая называется сердечной брыжейкой — mesocardium. Наконец объединяются и каудальные отделы сердечной трубки, благодаря чему возникает единая, в общем идущая еще прямо сердечная трубка.
Эта стадия развития образуется в течение четвертой эмбриональной недели. С самого начала отсутствует закладка вентральной сердечной брыжейки, а дорсальная сердечная брыжейка впоследствии исчезает почти что полностью.
Учебное видео развития сердца (эмбриогенеза)

– Также рекомендуем “Формирование камер сердца плода. Развитие перегородок сердца эмбриона”
Оглавление темы “Развитие костно-мышечной и сердечно-сосудистой систем плода”:
1. Окостенение черепа плода. Формирование костей черепа эмбриона
2. Висцеральный скелет. Формирование висцерального скелета плода
3. Скелет конечностей эмбриона. Формирование скелета верхних конечностей плода
4. Нижняя конечность эмбриона. Формирование суставов плода
5. Мышцы эмбриона. Развитие мышц плода
6. Формирование мускулатуры конечностей плода. Развитие мышц шеи эмбриона
7. Формирование мышц головы эмбриона. Развитие сосудистой системы плода
8. Кроветворение (гемопоэз) у плода. Развитие аорты у эмбриона
9. Развитие сердца у плода. Закладка сердечной трубки у эмбриона
10. Формирование камер сердца плода. Развитие перегородок сердца эмбриона
Источник

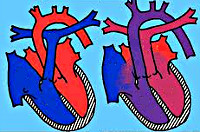
Транспозиция магистральных сосудов – тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов: отхождением аорты от правых отделов сердца, а легочной артерии – от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Общие сведения
Транспозиция магистральных сосудов – врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7–15%; в 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» – наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Транспозиция магистральных сосудов
Причины транспозиции магистральных сосудов
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии – над левым.
Классификация транспозиции магистральных сосудов
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
- с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция)
- с ДМЖП
- с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
- со стенозом выносного тракта левого желудочка
- с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция)
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Особенности гемодинамики при транспозиции магистральных сосудов
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и др.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
Симптомы транспозиции магистральных сосудов
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Клиническое течение корригированной транспозиции магистральных сосудов без сопутствующих ВПС длительное время бессимптомное, жалобы отсутствуют, ребенок развивается нормально. При обращении к кардиологу обычно выявляется пароксизмальная тахикардия, атриовентрикулярная блокада, шумы в сердце. При наличии сопутствующих ВПС клиническая картина корригированной транспозиции магистральных сосудов зависит от их характера и степени гемодинамических нарушений.
Диагностика транспозиции магистральных сосудов
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 – менее 20 мм рт.ст. При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых – в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение транспозиции магистральных сосудов
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка–Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку–Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга – внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен – в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз транспозиции магистральных сосудов
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85–90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Источник
К концу 2-й недели эмбрионального развития в мезодерме зародышевого листка появляются скопления клеток, образующие кровяные островки, которые в дальнейшем превращаются в первичные сосуды. Сердце развивается из удвоенной складки мезодермы. Вначале формируются два самостоятельных зачатка – первичные эндокардиальные трубки. В дальнейшем они сливаются в одну двухслойную первичную сердечную трубку, из которой формируются желудочки. Из внутреннего ее слоя развивается эндокард, а из наружного – миокард и эпикард. Первичная сердечная трубка располагается в полости перикарда вертикально впереди кишечной трубки. Она состоит из луковицы, или бульбуса (закладки артериального ствола), желудочковой и предсердной частей, венозного синуса, собирающего кровь из вен.
На 3-й неделе развития эмбриона происходит бурный рост трубки. В дальнейшем он замедляется, из-за чего трубка S-образно изгибается, ее венозный синус и предсердная часть поворачиваются влево, вверх и назад. В этой стадии первичное предсердие, включающее и венозный синус, растягивается, образуя два ушка. От общего желудочка оно отделено предсердно-желудочковой бороздой, в свою очередь желудочек отделен от луковицы вентрикуло-бульбарной бороздой. У этих борозд первичная сердечная трубка имеет сужения, на внутренней поверхности которых закладываются эндокардиальные подушечки, служащие в последующем основой для развития сердечных перегородок и клапанов.
Разделение сердца на правую и левую половины начинается с конца 3-й недели благодаря одновременному росту двух перегородок – одной из предсердия, другой – из верхушки желудочка. Растут они с противоположных сторон в направлении первичного предсердно-желудочкового отверстия. В предсердии сперва образуется первичная перегородка, разделяющая его на левую и правую половины. В задней ее части имеется овальное отверстие. В передненижнем отделе перегородка срастается с предсердно-желудочковыми клапанами. Вскоре начинает развиваться и вторичная перегородка. Со временем обе перегородки сливаются и только овальное отверстие остается открытым. Первичная перегородка прикрывает его в виде занавески, поэтому сброс крови происходит в одном направлении – справа налево. В таком виде овальное отверстие сохраняется до рождения ребенка. С началом дыхания и легочного кровообращения повышается давление в предсердиях (особенно в левом), перегородка прижимается к краю отверстия и сброс крови из правого предсердия в левое прекращается. В начале внеутробной жизни овальное отверстие закрыто только функционально, анатомическое закрытие происходит значительно позже.
Межжелудочковая перегородка начинает развиваться на 5-й неделе из мышечной части первичного желудочка, от верхушки в направлении общего предсердно-желудочкового отверстия, снизу вверх, разделяя его на две части. В ее образовании принимают участие эндокард и миокард. У границы предсердно-желудочкового отверстия она имеет круглое отверстие, которое в дальнейшем закрывается перегородкой, прорастающей из луковицы. В последующем из этого отдела образуется мембранозная часть перегородки. К концу 7-8-й недели сердце из двухкамерного превращается в четырехкамерное.
В луковице на 4-й неделе образуется перегородка, в результате чего возникает устье легочной артерии и аорты. При прорастании перегородки в головной отдел луковицы общий артериальный ствол делится на легочную артерию и аорту, которые между собой сообщаются с помощью артериального протока.
Миокард образуется из наружного (эпикардиального) слоя первичной сердечной трубки. На 2-м месяце на границе предсердно-желудочковой борозды в мышцу врастает соединительная ткань, из которой формируется фиброзное кольцо предсердно-желудочкового отверстия. Мышца предсердий в ходе развития остается тоньше, чем мышца желудочков.
В первые недели эмбриогенеза (до S-образного изгиба сердечной трубки) в мышце сердца закладываются основные элементы проводящей системы: синусно-предсердный узел, предсердно-желудочковый узел, пучок Гиса и миоциты сердечные проводящие (волокна Пуркинье). Проводящая система обильно снабжена кровеносными сосудами и между ее волокнами имеется большое количество нервных элементов.
Перикард образуется из наружных клеток первичной трубки сердца.
В процессе закладки и формирования сердце перемещается из шейного отдела в грудной. Структурное оформление сердца и крупных сосудов заканчивается на 7-8-й неделе развития эмбриона. Поэтому все аномалии развития сердечно-сосудистой системы возникают от 3-й до 8-й недели гестации.
В плацентарный период развития зародыша основные изменения сводятся к увеличению размеров сердца и объема мышечного слоя, дифференциации сосудов. В этот период из отдельных частей сердца и сосудов образуется сложная функциональная система – сердечно-сосудистая.
Первый триместр беременности (эмбриональная фаза развития зародыша) является критическим, так как в это время закладываются важнейшие органы человека. При воздействии на зародыш неблагоприятных факторов (генетических, физических, химических и биологических) может нарушиться сложный механизм эмбриогенеза сердечно-сосудистой системы, в результате чего возникают различные врожденные пороки сердца и магистральных сосудов.
Источник
