Для системы сосуд ткань эффективными осмолями
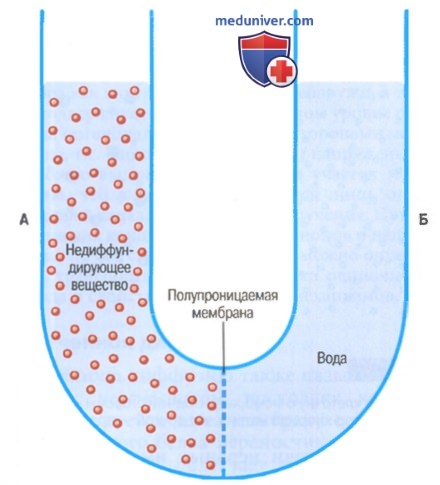
Осмотическое давление. Осмоляльность и осмольЕсли в условиях, к раствору хлорида натрия приложить давление, осмос воды в этот раствор замедлится, прекратится или пойдет в противоположном направлении. Точную величину давления, необходимого для прекращения осмоса, называют осмотическим давлением раствора хлорида натрия. Принцип перепада давления, противостоящего осмосу, демонстрируется на рисунке, где показана избирательно проницаемая мембрана, разделяющая два столба жидкости, один из которых содержит чистую воду, а другой — воду и любое растворенное вещество, не проникающее через мембрану. Осмос воды из отсека Б в отсек А ведет ко все большему перепаду уровней столбов жидкости до тех пор, пока в итоге разность давлений по обе стороны мембраны не станет достаточно большой, чтобы противостоять осмотическому эффекту. Разность давлений через мембрану в этот момент эквивалентна осмотическому давлению раствора, содержащего не проникающее через мембрану вещество. Значение количества осмотических частиц (молярной концентрации) в определении осмотического давления. Осмотическое давление, создаваемое растворенными частицами, независимо от того, являются ли они молекулами или ионами, определяется количеством частиц на единицу объема жидкости, но не их массой, т.к. каждая частица в растворе, независимо от ее массы, оказывает в среднем одинаковое давление на мембрану.
Так, большие частицы, имеющие большую массу (т), движутся с меньшей скоростью (v), чем малые частицы. Малые частицы движутся с более высокой скоростью, и средняя кинетическая энергия (к), определяемая уравнением: k=mv2/2, одинакова как для каждой малой, так и каждой большой частицы. Следовательно, фактором, определяющим осмотическое давление раствора, является его концентрация, выраженная количеством частиц (что для недиссоциирующих веществ аналогично молярной концентрации), но не показателем массы растворенного вещества. Один осмоль является 1 грамм-молекулой осмотически активного растворенного вещества. Так, 180 г глюкозы, т.е. 1 грамм-молекула глюкозы, эквивалентны 1 осмолю глюкозы, поскольку глюкоза не диссоциирует на ионы. Если растворенное вещество диссоциирует на 2 иона, 1 грамм-молекула растворенного вещества будет соответствовать 2 осмолям, поскольку число осмотически активных частиц в этом случае вдвое больше, чем для недиссоциирующего вещества. Следовательно, о растворе, содержащем 1 осмоль растворенного вещества в каждом килограмме воды, говорят, что его осмоляльность равна 1 осмоль на 1 кг. Раствор, содержащий 1/1000 осмоля растворенного вещества на 1 кг, имеет осмоляльность 1 миллиосмоль (мосм) на 1 кг. Нормальная осмоляльность внеклеточной и внутриклеточной жидкостей равна примерно 300 мосм на 1 кг воды. Связь осмоляльности с осмотическим давлением. При 37°С, т.е. при температуре, равной нормальной температуре тела, раствор с концентрацией 1 осмоль на 1 л воды создает осмотическое давление, равное 19300 мм. рт. ст. Следовательно, концентрация 1 моем на 1 л эквивалентна 79,3 мм. рт. ст. осмотического давления. Умножение этой величины на 300 мосм, т.е. на концентрацию частиц в жидкостях организма, дает общее расчетное осмотическое давление, равное 5790 мм рт. ст., однако измеренная реальная величина давления составляет в среднем только 5500 мм рт. ст. Причина такого различия заключается в том, что многие ионы в жидкостях организма, например ионы натрия и хлора, сильно притягиваются друг к другу и, следовательно, не могут двигаться совершенно свободно, реализуя свой полный осмотический потенциал. Термин «осмолярность». В связи со сложностью измерения воды в растворе в килограммах, что необходимо для определения осмоляльности, вместо этого показателя используют осмолярность, т.е. осмолярную концентрацию, выражаемую числом осмолей на 1 л раствора, а не количеством осмолей на 1 кг воды. Хотя, строго говоря, именно осмоли на 1 кг воды (осмоляльность) определяют осмотическое давление для таких разбавленных растворов, как жидкости организма, количественные различия между осмолярностью и осмоляльностью составляют менее 1%. – Также рекомендуем “Активный транспорт веществ через мембраны. Натрий-калиевый насос” Оглавление темы “Транспорт ионов и мембранные потенциалы клетки”: |
Источник
Осмос отражает движение молекул растворителя через мембрану в область с более высокой концентрацией раствора. Это движение можно замедлить, повышая давление на более концентрированный раствор. Величина такого давления – эффективное осмотическое давление. Уровень эффективного осмотического давления зависит в большей мере от количества, а не типа присутствующих частиц.
Количество осмотически активных молекул присутствующих в растворе выражается в осмолях. Один осмоль вещества равен его молекулярной массе в граммах (один моль) разделенному на количество свободных частиц, которые каждая молекула освобождает в растворе. Так, например, при растворении 180 г глюкозы в1 литре воды образуется раствор с молярной концентрацией в1моль/л и осмолярностью в 1 осмоль/л. Хлорид натрия ионизируется в растворе и каждый ион представляет осмотически активную частицу. При условии полной диссоциации на Na+ и Cl-, раствор, содержащий в 1 л 58,5 г NaCl имеет молярную концентрацию в 1 моль/л, а осмолярность в 2 осмоль/л.
В биологических жидкостях концентрация растворов гораздо меньше (ммоль/л), а диссоциация неполная. Следовательно, раствор NaCl содержащий 1 ммоль/л дает величину нескольку меньшую, чем 2 мосмоль/л. Термин осмоляльность отражает количество осмоль на единицу общей массы растворителя и в отличии от осмолярности не зависит от объема различных растворенных в растворе веществ. Смешение явно взаимонезаменяемых терминов осмолярность (измеряется в осмоль/л) и осмоляльность (измеряется в осмоль/кг) вызвано их арифметически одинаковыми значениями в биологических жидкостях: осмолярность плазмы составляет 280-310 мосмоль/л и осмоляльность плазмы – 280-310 мосмоль/кг. Это объясняется ничтожно малым объемом растворенного вещества в биологических жидкостях и фактом, что большинство осмотически активных частиц растворено в воде имеющей плотность равную 1, то есть, осмоль/л = осмоль/кг. Поскольку количество осмолей в плазме определяется путем измерения депрессии точки замерзания, то более точным термином для использования в клинической практике является осмоляльность.
Катионы (в основном Na+) и анионы (Cl- и HCO3-) являются главными осмотически активными частицами в плазме. Меньшую роль играют глюкоза и мочевина. Осмолярность плазмы (Р осм) можно определить по формуле:
Р осм = 2 [Na+]+Глюкоза крови + Мочевина крови = 290 мосмоль/л
(ммоль/л) (ммоль/л) (ммоль/л)
Осмолярность является химическим термином и его не следует смешивать с физиологическим термином тоничность. Этот термин используется для сравнения эффективного осмотического давления раствора по сравнению с таковым в плазме. Принципиальная разница между осмолярностью и тоничностью состоит в том, что омолярность зависит от всех растворенных частиц, в то время как тоничность определяется только частицами, которые не проходят через мембрану клетки. Следовательно, тоничность выражает осмолярную активность растворенных веществ, расположенных во внеклеточном пространстве, то есть тех, которые создают осмотические силы, оказывающие влияние на распределение воды между внутри- и внеклеточной жидкостями. Мочевина свободно переходит через мембрану и не воздействует на распределение воды между этими двумя жидкостными компартментами и не влияет на тоничность. Веществами, которые воздействуют на осмолярность, но не влияют на тоничность, являются также этанол и метанол, поскольку они быстро распределяются по всей воде тела. Но маннитол и сорбитол плохо проходят через мембраны и появляясь во внеклеточном пространстве влияют и на осмолярность и на тоничность. Тоничность плазмы можно определить по формуле:
Тоничность плазмы = 2 [Na+] + Глюкоза крови = 285 мосмоль/л
(ммоль/л) (ммоль/л)
Вода неравномерно распределена в организме.
В организме различают 2 главных водных пространства:
– внутриклеточное пространство которое представляет сумму водного содержимого каждой клетки организма
– внеклеточное пространство, которое включает жидкость, находящуюся вне клеток.
Соответственно пространствам различают внутриклеточную и внеклеточную жидкость. Внеклеточная жидкость локализована внутри сосудов и межклеточном интерстициальном пространстве. Разделение на два главных пространства не является искусственным. Оно обосновано как морфологически, так и функционально. Внутриклеточное пространство не является единым структурно-функциональным образованием в полном смысле этого слова. Внеклеточное же пространство, как среда существования для клеток и элемент межклеточного транспорта различных веществ представляет единую фазу во всех частях тела. Стенка сосудов, которая разделяет внутрисосудистую и интерстициальную часть внеклеточной жидкости, образует барьер только для высокомолекулярных веществ (белки) и клеток, в то время как низкомолекулярные вещества и неорганические ионы примерно одинаково распределяются по всему внеклеточному пространству. Доказательством служит одинаковый ионный состав плазмы крови и интерстициальной жидкости (табл.13-1 ).
Табл.13-1. Различия в электролитном составе вне и внутриклеточной жидкости( в ммоль/л)
| Электролиты | Плазма Крови | Внеклеточная жидкость | Внутриклеточная жидкость |
| Na+ | |||
| K + | |||
| Ca ++ | 2.5 | 2.5 | |
| Mg++ | |||
| H+ | 0.04 | 0.04 | 0.13 |
| Cl- | |||
| HCO3- | |||
| фосфат | |||
| SO43- | 0.5 | 0.5 | |
| органические кислоты | – | ||
| Белки | 70 г/л | <5г/л | 280 г/л |
Капиллярный эндотелий действует как свободно проницаемая мембрана для воды, катионов, анионов и многих растворимых соединений таких как глюкоза и мочевина (но не белков). В результате состав интерстициальной жидкости и плазмы одинаков. В каждой из них Na+ – основной катион, а Cl- – главный анион. Белок действует как катион, не проникающий через мембраны и присутствует в большей концентрации в плазме. Концентрация Cl- немного выше в интерстициальной жидкости для поддержания электрической нейтральности (Доннановское равновесие).
В отличие от внеклеточной жидкости во внутриклеточной жидкости основным катионом является калий, а главным анионом – фосфор Кроме того имеет место высокая концентрация белков. В отличии от капиллярного эндотелия клеточные мембраны характеризуются избирательной проницаемостью для различных ионов и свободно проницаемы для воды. Тем самым, уравновешивание осмотических сил происходит одновременно и достигается движением воды через клеточную мембрану. Осмолярность внутри- и внеклеточной жидкостей должна быть одинаковой. Вода быстро перемещается между внеклеточным и внутриклеточным компартментами для устранения или создания осмолярного градиента. Это фундаментальный принцип в понимании поведения воды и электролитов в организме.
Источник
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч. 1, ОФС 42-0047-07
Осмолярность – это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, а осмоляльность – концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
где:
Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:
(2),
где:
n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n=1,2,3…);
— молярный осмотический коэффициент, учитывающий взаимодействие между частицами в растворе и зависящий только от количества растворенного вещества.
Коэффициент определяется экспериментально.
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмолях на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7-1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида – 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле:
С(мОсм/л) = С(мОсм/кг) ∙ ρ (3)
где: ρ – плотность раствора, кг/л.
Примечания. 1. Расчет теоретических границ осмолярности проводят следующим образом: минимальное значение – осмолярность раствора, содержащего минимально допустимые количества ингредиентов; максимальное значение – осмолярность раствора, содержащего максимально допустимые количества ингредиентов.
- 2. При наличии в растворе высокомолекулярного вещества за его молярную массу берется средняя молекулярная масса фракции.
- 3. Гидрокарбонаты при расчете осмолярности учитываются как соли одноосновной кислоты.
Определение осмоляльности водных растворов
Для определения осмоляльности могут быть использованы следующие методы: криоскопический, мембранная и паровая осмометрия.
Криоскопический метод
Метод основан на понижении точки замерзания растворов по сравнению с точкой замерзания чистого растворителя.
1 осмоль на килограмм воды понижает точку замерзания на 1,86 °С. Измерение этих изменений лежит в основе криоскопического метода.
Данная зависимость может быть выражена следующей формулой:
где:
Сосм — осмоляльность раствора (мОсм/кг)
Т2 — температура замерзания чистого растворителя (˚С);
Т1 — температура замерзания испытуемого раствора (˚С);
К — криометрическая постоянная растворителя (для воды: 1,86).
В настоящее время определение осмоляльности растворов проводится с использованием автоматических криоскопических осмометров.
Необходимое количество испытуемого раствора помещают в ячейку прибора. Далее проводят измерение согласно инструкции, прилагаемой к прибору. При необходимости прибор калибруют с помощью стандартных растворов натрия или калия хлорида, которые перекрывают определяемый диапазон осмоляльности (таблица 1).
Таблица 1 – Стандартные справочные значения понижения температуры замерзания и эффективности осмотической концентрации водных растворов натрия и калия хлоридов
| Аналитическая концентрация соли р, г/кг Н2O | Понижение температуры замерзания DТзам., К | Эффективная (осмотическая) концентрация mэф, ммоль/кг Н2O |
| Растворы натрия хлорида | ||
| 5,649 | 0,3348 | 180 |
| 6,290 | 0,3720 | 200 |
| 9,188 | 0,5394 | 290 |
| 9,511 | 0,5580 | 300 |
| 11,13 | 0,6510 | 350 |
| 12,75 | 0,7440 | 400 |
| 16,00 | 0,9300 | 500 |
| Растворы калия хлорида | ||
| 7,253 | 0,3348 | 180 |
| 8,081 | 0,3720 | 200 |
| 11,83 | 0,5394 | 290 |
| 12,25 | 0,5580 | 300 |
| 14,78 | 0,6696 | 360 |
| 20,71 | 0,9300 | 500 |
Метод мембранной осмометрии
Метод основан на использовании свойства полупроницаемых мембран избирательно пропускать молекулы веществ.
Движущей силой процесса является процесс осмоса. Растворитель проникает в испытуемый раствор до установления равновесия; возникающее при этом дополнительное гидростатическое давление приближенно равно осмотическому давлению и может быть рассчитано по формуле:
(5)
где:
Осмоляльность может быть рассчитана по формуле:
Сосм =pосм / R ∙ T (6)
где R – универсальная газовая постоянная (8,314 Дж/мольК)
T – абсолютная температура (˚K).
Примечание. Данный метод применим только для растворов высокомолекулярных веществ (104 – 106 г/моль). При анализе растворов, содержащих электролиты и другие низкомолекулярные вещества, будет определяться только осмотическое давление, создаваемое высокомолекулярными компонентами раствора.
Определение осмоляльности испытуемого раствора проводят с помощью мембранного осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Метод паровой осмометрии
1 осмоль на килограмм воды понижает давление пара на 0,3 мм рт. ст. при температуре 25 °С. Измерение этих изменений лежит в основе метода паровой осмометрии.
Метод основан на измерении разности температур, которая возникает на термисторах, помещенных в измерительную ячейку, насыщенную парами растворителя в случае, если на один из них нанесена капля чистого растворителя, а на другой — испытуемого раствора. Разница температур возникает по причине конденсации паров растворителя на капле раствора, так как давление пара растворителя над этой поверхностью меньше. При этом температура капли раствора повышается за счет экзотермического процесса конденсации до тех пор, пока давление пара над каплей раствора и давление чистого растворителя в ячейке не сравняются. При нанесении на оба термистора чистого растворителя разность температур равна нулю. Разность температур практически пропорциональна моляльной концентрации раствора.
Определение осмоляльности испытуемого раствора проводят с помощью парового осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Скачать в PDF ОФС.1.2.1.0003.15 Осмолярность
Источник
