Двойное отхождение сосудов от правого желудочка мкб
Определение
Двойное отхождение сосудов от правого желудочка, далее ДОСПЖ (частичная транспозиция, двойной выход из правого желудочка, аномалия Тауссиг — Бинга), — группа врожденных пороков сердца, чаще генетически обусловленных (мутации генов GDF1 (19p13.11) и CFC1 (2q21.2) кардиальных клеток-предшественников), характеризующаяся аномальным типом вентрикуло-артериальной связи, при которой аорта и легочный ствол полностью или преимущественно происходят от правого желудочка, возникающей вследствие нарушения ротации конуса и его вклинения между атриовентрикулярными клапанами и сопровождающейся нарушением формирования выхода из левого желудочка.
Код по МКБ-10 Q20.1 — Удвоение выходного отверстия правого желудочка.
Код по МКБ-11 LA85.2 — Double outlet right ventricle.
Эпидемиология
Клинически частота встречаемости данного порока составляет 0,7 %, что довольно редко, а вот по патологоанатомическим — 2,7 %, что говорит о низкой частоте выявления и ранней смертности лиц с данным заболеванием. Если взять все врожденные пороки сердца в Российской Федерации, то лишь у 1,5 % больных проводится оперативная коррекция данного порока, при средней летальности, составляющей почти 10 %. Прогноз течения порока во многом зависит от его типа и, соответственно, варианта гемодинамики.
Продолжительность жизни выше у больных с гемодинамически более благоприятным течением, а именно с обструкцией выхода из правого желудочка. В целом, время, в течении которого умирают 50 % пациентов с данной аномалией, не превышает и 5 лет, и лишь 17 % больных со всеми типами порока доживают до 15 лет.
Классификация
– ДОСПЖ типа тетрады Фалло ДМЖП в данном случае расположен подаортально или подартериально, сочетаясь с обструкцией выхода из правого желудочка;
– ДОСПЖ типа ДМЖП характеризуется тем же, но при условии отсутствия обструкции выхода из правого желудочка;
– ДОСПЖ типа транспозиции магистральных сосудов характеризуется отсутствием обструкции выхода из правого желудочка, а ДМЖП располагается подлегочно;
– ДОСПЖ с некоммитированным ДМЖП проявляется наличием ДМЖП в синусном или трабекулярном отделе перегородки, может сочетаться с обструкцией выхода из правого желудочка.

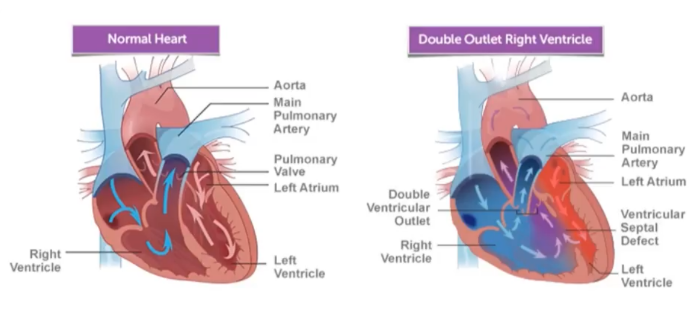
Рис. 1
Гемодинамика при анатомически нормальном строении сердца (слева), и при ДОСПЖ (справа).
Диагностика
Диагностика данного заболевания складывается из характерных симптомов сердечной недостаточности, которые проявляются с рождения. Золотым стандартом выявления данного порока является ЭхоКГ, которая позволяет оценить анатомическую структуру сердца и его гемодинамику. Пренатальная диагностика возможна, однако ее выполнение очень затруднительно.
Клинический случай
В отделение кардиологии БСМП поступил больной И., 18 лет, с жалобами на одышку смешанного характера, возникающей при подъеме на второй этаж, при прохождении около 100 метров, на периодический сухой приступообразный кашель, на повышенную утомляемость.
Из анамнеза: с детства отмечались низкая скорость роста, низкая прибавка в весе и толерантность к физической нагрузке. В возрасте двух лет установлен диагноз: ВПС, ДОСПЖ. От предложенного оперативного лечения родители отказались, боясь того, что ребенок не перенесет операцию. В возрасте 17 лет стал отмечать нарастание одышки, снижение толерантности к физической нагрузке. Обратился к кардиологу, назначена терапия ХСН.
Заочно консультирован кардиохирургом Научного центра сердечно-сосудистой хирургии, где по предоставленным данным «у больного сложный врожденный порок сердца, который в отсутствии коррекции в детском возрасте привел к высокой легочной гипертензии со значительной дилатацией легочной артерии, недостаточности клапана легочной артерии III ст. Выполнить оперативное лечение не представляется возможным. Рекомендована консервативная терапия».
При осмотре обращает на себя внимание астеничность телосложения, цианоз носогубного треугольника. В легких дыхание с жестким оттенком, единичные застойные хрипы в нижних отделах. При аускультации сердца выслушивается акцент II тона над легочной артерией, систолический шум над всеми точками аускультации, ЧСС 80 ударов в минуту. Артериальное давление симметричное на обеих руках, с тенденцией к гипертензии, 135 и 85 мм.рт.ст.
Из лабораторных данных обращает на себя внимание общий анализ крови, где отмечается компенсаторная полицитемия за счет роста числа эритроцитов 7,8×1012/л повышение уровня гемоглобина до 173 г/л и гематокрита.
При инструментальном обследовании:
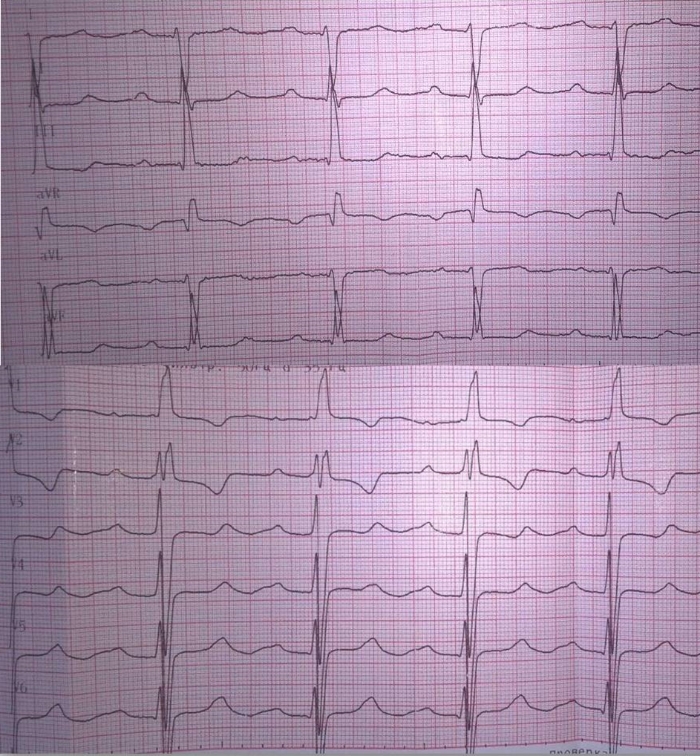
Рис. 2
Электрокардиограмма пациента при поступлении. На фоне синусового ритма с ЧСС 85 ударов в минуту отмечаются признаки гипертрофии левого желудочка и неполной блокады правой ножки пучка Гиса.
При проведении ЭхоКГ: Большой высокий дефект межжелудочковой перегородки. Фиброзные изменения створок аортального клапана, умеренный стеноз устья аорты, аортальная недостаточность II-III ст. Фиброз створок клапана легочной артерии. Недостаточность клапана легочной артерии II-III ст. Концетрическая значительная гипертрофия миокарда правого желудочка. Умеренная дилатация правого предсердия. Относительная трикуспидальная недостаточность II степени. Значительная дилатация ствола и ветвей легочной артерии. Значительная легочная гипертензия.
По рентгенографии органов грудной клетки отмечается расширение тени сердца влево. Признаки гиперволемии по малому кругу кровообращения.
Пациенту была скорректирована терапия ХСН с учетом выраженной легочной гипертензии с последующей титрацией дозы препаратов на амбулаторном этапе.
Лечение
Больным с ДОСПЖ при явлениях сердечной недостаточности на этапе предоперационной подготовки рекомендуются диуретики, иАПФ, сердечные гликозиды, β-адреноблокаторы, катехоламины.
Больным с ДОСПЖ типа тетрады Фалло рекомендуются β-адреноблокаторы и бензодиазепины при приступе гипоксии.
Больным с ДОСПЖ для лечения легочной гипертензии рекомендуются антагонисты кальция, блокаторы эндотелиновых рецепторов (например, Бозентан, Амбризентан), ингибиторы фосфодиэстеразы типа 5 (например, Силденафил, Варденафил), аналоги простагландинов (например, Илопрост).
Вид оперативной коррекции определяется размерами левого желудочка и, соответственно, локализацией дефекта межжелудочковой перегородки. Многие пациенты перед выполнением реконструктивной коррекции данного порока подвергаются паллиативным операциям, особенно если левый желудочек гипоплазирован или имеет пограничный размер.
Паллиативные операции строятся из шунта Блелока-Тауссинга (анастомоз между подключичной и легочной артерий) и бандинга легочной артерии (сужения легочной артерии), а иногда вначале выполняется резекция коарктации аорты либо первая стадия процедуры Норвуда (коррекция гемодинамики, путем уменьшения нагрузки на легочную артерию, вызванную повышенным кровотоком).
Учитывая то, что обструктивное поражение сосудов легких развивается столь же быстро, как и при ДМЖП, пациентов с ДОГПЖ следует оперировать рано в младенческом возрасте (до 6 месяцев). В настоящее время ранний возраст не следует рассматривать как фактор госпитальной летальности. Предпочительным методом операции является создание внутрижелудочкового туннеля с помощью заплаты из дакрона либо ткани Гортекс, соединяющего ЛЖ с аортой. Некоторым детям предварительно производится бандинг легочной артерии, однако не следует считать это правилом — гораздо важнее ранняя коррекция порока.
При рестриктивном дефекте межжелудочковой перегородки (когда размер менее диаметра аортального клапана), его расширяют при помощи антеросептального разреза либо иссечением в этой области межжелудочкового гребня. Создающие обструкцию в выводном тракте мышечные пучки иссекают с целью формирования прямого туннеля между аортой и ДМЖП.
Заключение
По частоте встречаемости данный порок весьма редок. По данным некоторых авторов данная аномалия встречается у 2-3 % детей, родившихся с врожденными пороками сердца. Однако редкость возникновения данного порока не исключает вероятности встречи с ним. Следует помнить, что данная патология требует оперативного лечения в раннем возрасте (до 6-ти месяцев), а медикаментозная терапия является поддерживающей и лишь отдаляет исход неизбежно нарастающей ХСН.
Источники:
- Клинические рекомендации ассоцииации сердечно-сосудистых хирургов России, «Двойное отхождение сосудов от правого желудочка» 2016 г.
- Бокерия Л.А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
- Смирнов Н.Н. Двойное отхождение сосудов от правого желудочка: особенности пренатальной диагностики. Пренатальная диагностика, 2009.-N 1.-С.37-40
- The portal for rare diseases and orphan drugs. Double outlet right ventricle.
Источник
Рубрика МКБ-10: Q20.3
МКБ-10 / Q00-Q99 КЛАСС XVII Врожденные аномалии пороки развития, деформации и хромосомные нарушения / Q20-Q28 Врожденные аномалии пороки развития системы кровообращения / Q20 Врожденные аномалии (пороки развития) сердечных камер и соединений
Определение и общие сведения[править]
Транспозиция магистральных сосудов (ТМС)
Транспозиция магистральных сосудов (ТМС) – ВПС (врожденный порок сердца), при котором два основных магистральных ствола расположены аномально: аорта исходит из морфологически правого (венозного) желудочка, а легочный ствол – из морфологически левого (артериального) желудочка. При этом атриовентрикулярные клапаны сформированы и лоцируются правильно, полые вены нормально впадают в правое предсердие, легочные вены – в левое. В результате создаются два разомкнутых круга кровообращения.
Синонимичны такие обозначения порока, как простая ТМС, истинная ТМС, некорригированная ТМС, цианотическая ТМС.
Эпидемиология
Частота порока среди всех ВПС, по клиническим данным, колеблется от 4,2 до 9,9%, а по секционным – от 15,7 до 20,8%. По частоте среди «синих» пороков сердца ТМС занимает 2-е место после ТФ, но это самый частый ВПС, сопровождающийся цианозом и недостаточностью кровообращения у новорожденных, поэтому при катетеризации полостей сердца В.И. Бураковским и соавт. (1973) ТМС у новорожденных обнаружена в 27% случаев, у детей в возрасте до 3 мес – в 16,7% случаев, до 6 мес – в 9,4% случаев, до 12 мес – в 4% случаев, до 2 лет – в 1,2% случаев, старше 2 лет – в 0,5% случаев. По нашим данным, порок выявляется в 1,7% всех случаев ВПС.
Порок встречается преимущественно у мальчиков, на долю которых приходится 57-88% всех случаев ТМС
Этиология и патогенез[править]
Гемодинамика. В нормальных условиях БКК (большой круг кровообращения) и МКК (малый круг кровообращения) связываются между собой в последовательной цепи, при транспозиции магистральных сосудов оба круга кровообращения разобщены и функционируют параллельно. Поэтому адаптивно-компенсаторное функционирование сердечно-сосудистой системы возможно только при двустороннем шунтировании и смешении веноартериальной крови обоих кругов кровообращения на уровне естественных и патологических коммуникаций (через бронхиальные артерии, открытое овальное отверстие, ДМПП (дефект межпредсердной перегородки), ДМЖП (дефект межжелудочковой перегородки), ОАП – открытый артериальный проток).
Во внутриутробном периоде из-за особенностей плацентарного кровообращения кровь, поступающая в правое предсердие из верхней полой вены, менее оксигенирована и в основном движется через правый желудочек в восходящую аорту, питая верхние конечности, головной мозг и миокард. Более оксигенированная кровь из нижней полой вены шунтируется через овальное отверстие в левое предсердие и затем через левый желудочек выбрасывается в ствол легочной артерии, откуда через ОАП шунтируется в нисходящую аорту.
Таким образом, в антенатальном периоде, когда кровообращение плацентарное и не функционирует МКК, организм плода через естественные коммуникации снабжается достаточно оксигенированной кровью и его развитие не страдает.
После рождения, с началом функционирования МКК (малый круг кровообращения), кровь из легочного ствола поступает в сосуды МКК, давление в которых прогрессивно снижается, и перестает сбрасываться через ОАП в нисходящую аорту. Повышение давления в аорте и снижение его в легочной артерии приводит к увеличению аортолегочного градиента давления, сбросу крови через ОАП в МКК и возрастанию легочного кровотока. При сохраненном овальном отверстии происходит смешение веноартериальной крови на уровне предсердий, при этом всегда имеется двустороннее шунтирование крови, когда в систолу и диастолу кровь попеременно сбрасывается из одного круга кровообращения в другой.
Необходимость функционирования данного компенсаторного механизма очевидна, ибо в противном случае, при одностороннем сбросе крови, один из кругов кровообращения был бы обескровлен. При наличии двух перегородочных дефектов возможно шунтирование в противоположных направлениях. Естественно, что чем больше коммуникаций и чем шире их просвет, тем значительнее смешение веноартериальной крови и выше ее оксигенация. Наилучшие гемодинамические условия создаются при наличии двух больших перегородочных дефектов.
Другие способы компенсации – коллатеральное кровообращение через бронхиальные сосуды легких, увеличение количества циркулирующей крови и ее кислородной емкости (полицитемия, полиглобулия).
Естественно, что даже при наличии всех перечисленных адаптационно-компенсаторных механизмов и коммуникаций, оксигенацию крови нельзя считать адекватной и всегда имеются артериальная гипоксемия и гипоксия.
Ввиду того, что правый желудочек функционирует в режиме БКК (большой круг кровообращения), против высокого периферического сопротивления в аорте, он значительно гипертрофируется. Левый желудочек претерпевает перегрузку объемом из-за увеличенного легочного кровотока, поэтому он гипертрофируется значительно меньше. Однако при наличии сопутствующего стеноза легочной артерии или вследствие развития склеротических изменений в сосудах легких гипертрофия миокарда левого желудочка также становится выраженной.
Клинические проявления[править]
Транспозиция магистральных сосудов – типичный цианотический ВПС (врожденный порок сердца). Однако характер клинических изменений и
нарушений гемодинамики в значительной мере обусловлен количеством и размерами сопутствующих компенсирующих коммуникаций и других дефектов, состоянием МКК. Поэтому, несмотря на множество имеющихся классификаций ТМС, большинство вариантов порока можно объединить в две группы.
1. ТМС с нормальным или увеличенным легочным кровотоком:
а) с открытым овальным отверстием или с ДМПП (дефект межпредсердной перегородки);
б) с ДМЖП (дефект межжелудочковой перегородки);
в) с ОАП или их сочетанием.
2. ТМС с уменьшенным легочным кровотоком:
а) со стенозом выходного отдела левого желудочка;
б) с ДМЖП (дефект межжелудочковой перегородки) и стенозом выходного отдела левого желудочка.
У значительного числа больных грудного возраста (80%) выявляется ТМС в сочетании с одной или несколькими коммуникациями, причем в 85-90% этих случаев порок протекает с гиперволемией МКК.
Большинство детей рождаются с нормальной длиной и массой тела и даже с ее превышением. Однако Т.В. Парийская и В.И. Гикавый (1989) обнаруживали умеренное снижение массы тела у 50% таких новорожденных. В дальнейшем быстро прогрессируют гипотрофия и отставание в физическом и психомоторном развитии.
Порок, как правило, диагностируется уже в роддоме по цианозу, имеющемуся у ребенка с первых дней жизни. Интенсивность цианоза различна, но он выявляется практически у всех новорожденных. Наряду с общим цианозом, у большинства детей имеется одышка и тахикардия. Тяжесть цианоза обратно коррелирует с количеством коммуникаций. Самый тяжелый цианоз отмечается при наличии одной коммуникации на уровне овального отверстия. Интенсивность цианоза и одышка значительно возрастают при сосании и плаче. Редко наблюдается дифференцированный цианоз, когда верхняя половина тела более цианотична, чем нижняя: при сочетании ТМС с предуктальной коарктацией аорты и функционирующим ОАП, что обусловливает сброс оксигенированной крови по градиенту давления из легочной артерии через ОАП в нисходящую аорту.
Физикально у новорожденных область сердца не изменена, однако к месячному возрасту быстро нарастает кардиомегалия за счет прогрессирующей гипертрофии и дилатации правого желудочка. Сердечный толчок усилен, видна прекардиальная пульсация. Периферическая пульсация удовлетворительная, АД нормальное. Границы сердца расширены в поперечнике. У более старших детей может возникать центральный сердечный горб. I тон на верхушке громкий, II – акцентирован, особенно при наличии ДМЖП. Позднее, при развитии НК, может выслушиваться трехчленный ритм «протодиастолического галопа».
Независимо от типа сопутствующих дефектов, для ТМС специфичен не только тотальный цианоз, но и рано развивающаяся недостаточность кровообращения. Наиболее тяжело и критически протекают варианты порока, при которых имеется лишь одна коммуникация. В частности, самое неблагоприятное течение с тяжелой одышкой, цианозом, тахикардией и застойной (рефрактерной к терапии) недостаточностью кровообращения наблюдается при простой ТМС, т.е. при наличии небольшой коммуникации в виде незаращенного овального отверстия. Такие больные часто умирают в первые недели жизни.
Клинические проявления ТМС, при сочетании с большим ДМЖП или наличии двух больших перегородочных коммуникаций, выражены слабее, и дети живут более 3-6 мес, так как за счет хорошего смешения крови обеспечивается ее удовлетворительная оксигенация, соответственно уменьшаются гипоксемия и гипоксия. Однако при этом возникают сильная гиперволемия МКК, легочная гипертензия и перегрузка левого желудочка.
Следует подчеркнуть, что ранняя рефрактерная недостаточность кровообращения обусловлена не только аномальной циркуляцией крови в двух плохо коммуницируемых кругах кровообращения и значительной объемной и систолической перегрузкой обоих желудочков сердца. В неменьшей степени НК связана с сердечной недостаточностью, обусловленной коронарной гипоксемией из-за поступления в венечные сосуды неоксигенированной крови из аорты.
У детей, которые живут более 3-6 мес, на фоне общего цианоза отмечаются значительное отставание в массе тела, задержка моторных функций и психического развития. Появляются признаки хронической гипоксии – изменение концевых фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»). Грудная клетка вздута (вследствие стойкой гипервентиляции). В результате кардиомегалии развивается сердечный горб. Живот атоничный, увеличен в объеме, печень увеличена, умеренно болезненна. Периферические отеки незначительны. При сочетании ТМС с ДМЖП и ДМПП вследствие гиперволемии МКК у больных отмечается склонность к рецидивирующим бронхитам и застойно-бактериальным пневмониям, на фоне которых может наступать значительное ухудшение состояния и смерть.
Дискордантное желудочково-артериальное соединение: Диагностика[править]
В анализах крови – полицитемия за счет увеличения содержания эритроцитов более 5-6 млн, полиглобулия (концентрация гемоглобина более 180-200 г/л), высокий показатель гематокрита, низкая СОЭ (1-2 мм/ч). Полицитемия и полиглобулия, как и при всех цианотических пороках, компенсаторные, повышают кислородную емкость крови, а снижение СОЭ связано с увеличением вязкости крови. В то же время у некоторых детей развивается релятивная или абсолютная анемия, что ухудшает прогноз заболевания.
Электрокардиография. ЭОС отклонена вправо. У всех больных с ТМС, независимо от сопутствующих дефектов, к 3-4-й нед жизни уже появляются признаки гипертрофии правого желудочка и правого предсердия. К 3-6-му мес жизни при наличии сопутствующего ДМЖП и ОАП может обнаруживаться гипертрофия и левого желудочка в виде сочетанной гипертрофии желудочков с преобладанием правого. Раннее нарастание признаков левожелудочковой гипертофии встречается редко и может свидетельствовать о сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии.
Фонокардиография. Амплитуда I и II тонов хорошая. При простой ТМС в точке 2 ЛС может регистрироваться короткий низкоили среднеамплитудный и среднечастотный систолический шум на 1/3-1/2 систолы, трудноотличимый от функционального шума. При сочетании ТМС с ДМЖП в точке 3-4 ЛС регистрируется высокоили среднеамплитудный высокочастотный шум, занимающий 2/3 систолы. При сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии амплитуда II тона не уменьшается, так как представлена аортальным компонентом II тона, лучше передающегося с расположенного спереди аортального клапана, а систолический высокочастотный среднеамплитудный шум регистрируется преимущественно в точке 2 ЛС.
Эхокардиография. Эхокардиографическая диагностика основана на идентификации основных магистральных сосудистых стволов, желудочков и их клапанного аппарата. В режиме 2D при парастернальном доступе по короткой оси на уровне магистральных сосудов аорта лоцируется спереди (переднеправая или переднелевая позиция) от легочной артерии. Идентификация переднего магистрального сосуда как аорты основывается по направлению хода сосуда вверх, а заднего магистрального сосуда – по ходу назад, с переходом в бифуркацию легочной артерии.
В апикальной позиции по длинной оси левого желудочка выявляются отхождение легочной артерии от левого желудочка и полулунномитральное продолжение, а также параллельная ориентация выводных трактов желудочков и обоих магистральных сосудов.
Косвенными признаками ТМС считаются увеличение толщины стенок и полости правого желудочка.
Рентгенография. Легочный рисунок, как правило, усилен по артериальному руслу, особенно при сочетании ТМС с ДМЖП и ОАП. Характерны форма и размеры сердца, его контуры напоминают «яйцо, лежащее на боку». Обычно сердце увеличено во все стороны. При исследовании в динамике отмечается нарастание с каждым месяцем кардиомегалии, как за счет гипертрофии и дилатации правых отделов сердца, так и за счет утяжеления сердечной недостаточности. Сердце часто становится шарообразной формы с узким сосудистым пучком, обнаруживаемым в сагиттальной проекции, который обусловлен расположением легочной артерии позади аорты. В боковой и косых проекциях сосудистый пучок становится широким.
При сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии легочный рисунок обеднен. Оба желудочка увеличены, однако кардиомегалия менее выражена, чем при большом ДМЖП и гиперволемии МКК. Возможно западение дуги легочной артерии по левому контуру сердца.
Катетеризация полостей сердца позволяет не только провести наиболее информативное диагностическое обследование, но и осуществить ряд лечебных мероприятий (закрытую баллонную атриосептостомию) новорожденным, находящимся в критическом состоянии. Исследования проводят последовательно при катетеризации правых, а затем (через овальное отверстие или ДМПП) и левых отделов сердца.
При ангиографии контрастирующее вещество из правого желудочка попадает преимущественно в восходящую аорту, расположенную спереди. Хорошо видны магистральные сосуды, расположенные параллельно.
Дифференциальный диагноз[править]
Дифференциальный диагноз следует проводить со всеми цианотическими пороками.
Дискордантное желудочково-артериальное соединение: Лечение[править]
Естественное течение и прогноз.
При естественном течении ТМС прогноз неблагоприятный, так как большая часть детей умирают в первые 3-6 мес жизни. В первые недели жизни умирают около 30% больных;
к месячному возрасту – 45-50%; к 3 мес жизни – около 70%; к 6 мес жизни – 75%; к 1 году жизни – 80-90%; до 2 лет доживают не более 7% больных. Тем не менее наблюдаются случаи, когда больные доживают до школьного возраста (Shaher R.M., 1973; Paul M., Wernovsry G., 1995). При этом средняя продолжительность жизни, как и характер течения порока, во многом определяется наличием и типом сопутствующих коммуникаций и других дефектов. При простой ТМС и малой величине перегородочных коммуникаций средняя продолжительность жизни не превышает 1-3 мес, при больших перегородочных дефектах – от 8 мес до 2 лет, а при сочетании большого ДМЖП с умеренным стенозом легочной артерии (что является наилучшей корригирующей комбинацией) – до 4-5 лет.
Основными причинами смерти являются сердечная недостаточность, тяжелая гипоксия и ацидоз и часто наслаивающиеся застойнобактериальные пневмонии.
Хирургическая коррекция порока – единственный способ спасения больных, и чем раньше она проведена, тем больше шансов на выживание пациента, так как на поздних этапах возникают тяжелейшие дистрофические изменения во всех органах и тканях, прежде всего в миокарде. Проводят как паллиативные, так и корригирующие радикальные операции. В первые месяцы жизни, особенно при простой ТМС и критических состояниях новорожденных, часто выполняются паллиативные операции, которые позволяют продлить жизнь больных до годовалого возраста, когда радикальные корригирующие операции выполняются легче и лучше переносятся пациентами.
Из паллиативных операций, направленных на создание удовлетворительной коммуникации на уровне предсердий, наиболее простой и наименее травматичной считается закрытая катетерная атриосептостомия (Рашкинда-Парка). Суть операции заключается в том, что катетер с находящимся на его конце баллончиком вводят через правое предсердие и перегородочное отверстие в левое предсердие. Затем баллончик раздувается, и при его выведении через узкое межпредсердное отверстие вновь в правое предсердие осуществляется тракция, при которой происходят разрыв и расширение МПП. При проведении этой операции у детей после 1-2 мес, когда МПП становится более плотной, вначале вводят катетер со складывающимся на его кончике лезвием ножа. Им делают насечки на МПП, а затем баллончиком Рашкинда разрывают и расширяют МПП.
В настоящее время операции Мастарда и Сеннига выполняют редко, а наиболее распространенной корригирующей операцией, выполняемой до 2-3-недельного возраста, является операция Жатене – ретранспозиция магистральных сосудов с реимплантацией венечных артерий (операция switch). Операция выполняется при всех вариантах отхождения венечных артерий. Целесообразно проводить ее пациентам в возрасте 2-3 нед, когда левый желудочек способен поддерживать системное кровообращение.
Летальность после операций Жатене в клиниках, где проведено значительное количество операций switch, составляет менее 10%.
У детей старше 2-3 нед рекомендуется выполнять паллиативную операцию сужения легочного ствола с одновременным наложением системно-легочного анастомоза. Радикальную коррекцию порока по методу Жатене целесообразно проводить через 3-6 мес после паллиативной.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Пороки сердца у детей и подростков: Руководство для врачей [Электронный ресурс] / Мутафьян О.А. – М. : ГЭОТАР-Медиа, 2009. – https://www.rosmedlib.ru/book/ISBN9785970409756.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник