Порок сосудов у новорожденных
Выхаживание детей с врожденными пороками сердца
Нормальное строение сердца ребенка
Сердце – это мышечный орган, который постоянно перекачивает кровь по организму, посылая насыщенную кислородом и питательными веществами кровь ко всем клеткам тела. Сердце состоит из двух верхних камер (предсердий, правого и левого) и двух нижних (желудочков, правого и левого). Из правого предсердия кровь через трехстворчатый клапан попадает в правый желудочек, затем в легочный ствол ( один из двух основных сосудов сердца ), а оттуда в легкие. В легких кровь обогащается кислородом и по легочным венам поступает в левое предсердие. Затем через митральный клапан – в левый желудочек, потом в аорту (главный сосуд сердца) и распределяется по всему организму. Кровь, бедная кислородом оттекает по венам от всех органов и тканей и поступает в правое предсердие
Коарктация аорты
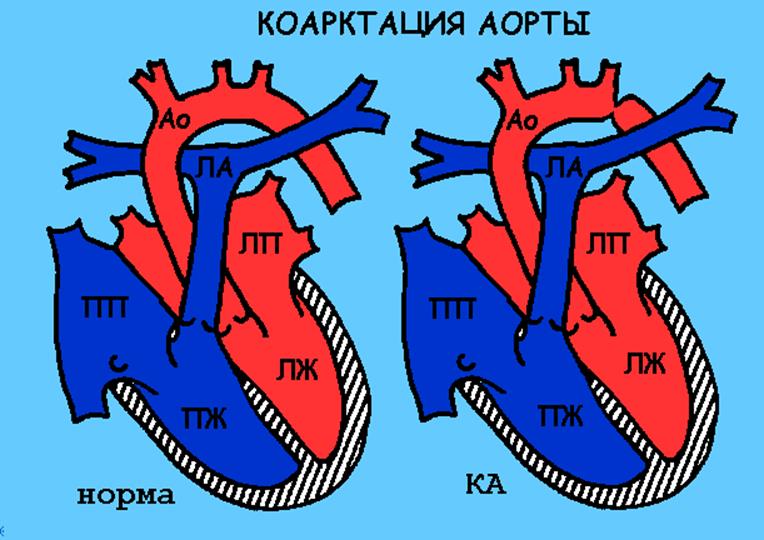
Описание порока
При данном виде порока имеется сужение (коарктация, КА) основного сосуда сердца – аорты. Это приводит к повышению нагрузки на левый желудочек сердца, который вынужден перекачивать большой объем крови через узкое отверстие. Сердце начинает быстро увеличиваться в размерах, не справляется с такой нагрузкой и у ребенка развивается недостаточность кровообращения. При резком сужении аорты кровоснабжение нижней половины туловища возможно только за счет функционирующего открытого артериального протока.
Каковы последствия
- при небольшом сужении аорты детей наблюдает кардиолог, контролируя состояние ребенка и размеры сердца. Операция выполняется в течение первых лет жизни.
- при выраженном сужении оперативное вмешательство показано в кратчайшие сроки.
Тетрада фалло
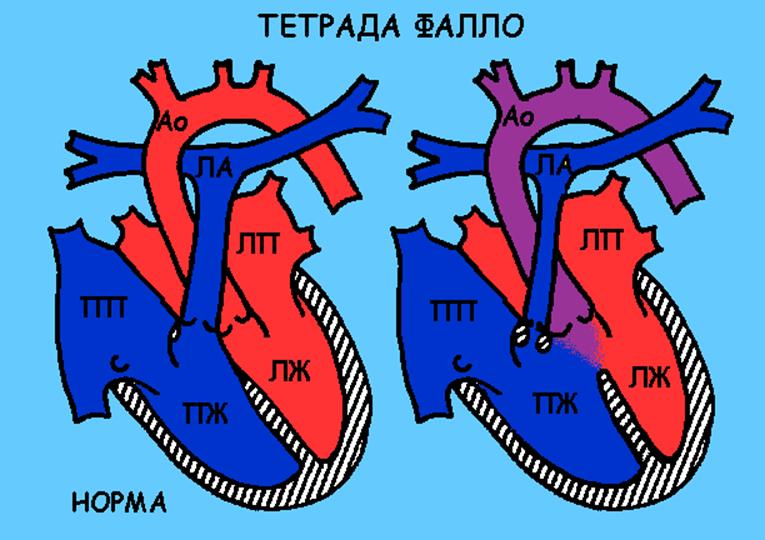
Описание порока
В данном случае сужено место отхождения легочной артерии в результате избыточного развития (гипертрофии) мышцы правого желудочка, сама артерия уменьшена в размерах, кроме того, обязательно имеется сообщение между двумя желудочками. То есть с одной стороны создается препятствие для выхода крови из правых отделов сердца, а с другой стороны избыточное количество крови поступает в правый желудочек.
В результате этого возникает двойная перегрузка правых отделов сердца, которая со временем приводит к необратимым изменениям сердечной мышцы. Кожа ребенка имеет синюшный цвет.
К 4-6 месяцам у ребенка могут появиться приступы нехватки воздуха из-за выраженного сужения выходной части правого желудочка (то есть из-за недостатка крови в легких).
Лечение
Таким пациентам обязательно надо будет делать операцию для восстановления проходимости легочной артерии, и закрывать дефект межжелудочковой перегородки. Операция выполняется на первом году жизни.
Общий артериальный ствол
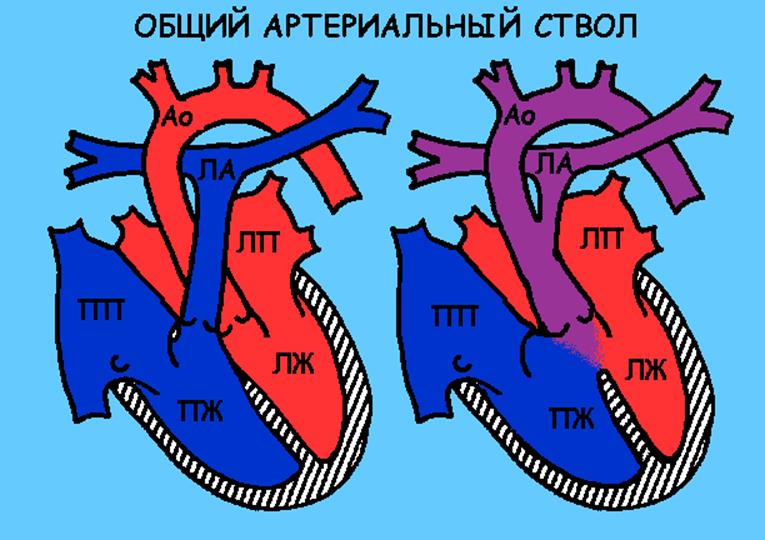
Описание порока
Общий артериальный ствол (ОАС) – порок сердца «синего типа». В данном случае от обоих желудочков сердца отходит один сосуд, по которому течет смешанная (артериальная + венозная) кровь. Обязательно существует отверстие в межжелудочковой перегородке, чтобы кровь из обоих желудочков могла попасть в общий сосуд. Этот сосуд затем делится на аорту и легочную артерию. Наличие смешанной крови в легочной артерии приводит к плохому насыщению крови кислородом в легких, что в свою очередь определяет кислородное голодание мозга и других органов. Очень часто клапан общего сосуда работает неправильно (недостаточно хорошо закрывается или имеется сужение) и это также осложняет работу сердца. Размеры сердца резко увеличены с рождения.
Лечение
С первых дней жизни при данном виде порока развивается выраженная недостаточность кровообращения, состояние ребенка прогрессивно ухудшается, несмотря на проводимое лечение. Операция требуется в течение 1-го месяца жизни. Очень велика вероятность внезапной смерти.
Аномалия Эбштейна
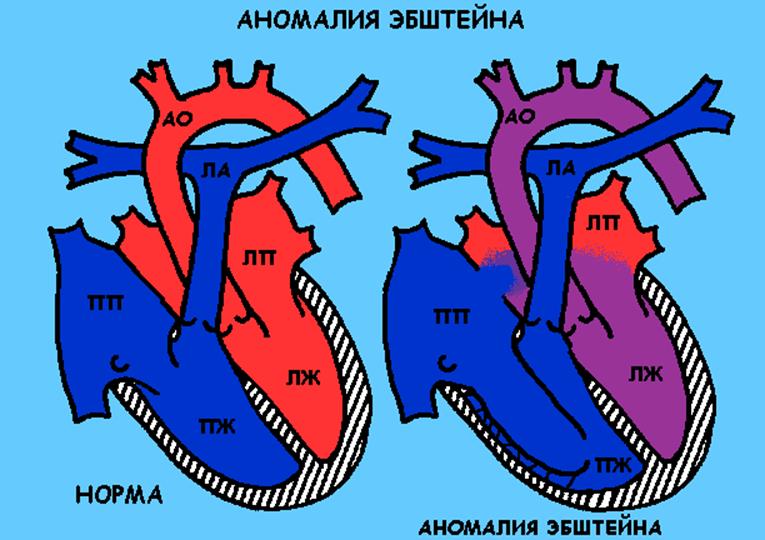
Описание порока
Трехстворчатый клапан смещен в полость правого желудочка, за счет чего размер правого желудочка резко уменьшен. Большая часть правого желудочка образует с правым предсердием гигантскую полость. В результате этого порока правый желудочек не справляется со своей функцией перекачивания крови в легкие, работает с большой нагрузкой, растягивается, что, в конечном счете, приводит к развитию недостаточности кровообращения, выраженному ограничению физических нагрузок.
Лечение
В зависимости от степени смещения створок клапана операция может выполняться как в раннем возрасте, так и после 1 года.
Дефект межжелудочковой перегородки
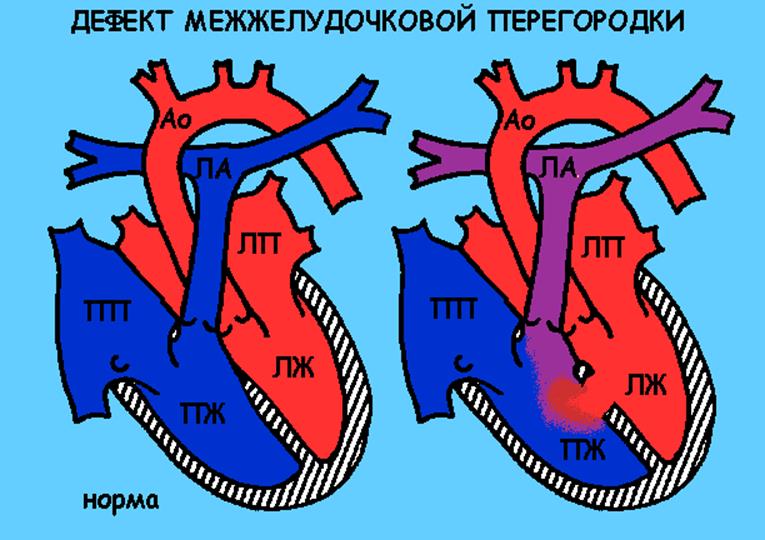
Описание порока
В норме не существует сообщения между двумя желудочками. При данном виде порока кровь в силу разницы давлений между желудочками поступает из левой камеры в правую. В результате этого правый желудочек переполняется кровью, избыточное количество которой затем поступает в легкие (легкие «заливаются» кровью). Следствием этого является уменьшение количества кислорода, который поступает к различным органам, т.е. ребенок начинает испытывать кислородное голодание. Кроме того, очень велика вероятность развития воспаления легких.
КАКОВЫ ПОСЛЕДСТВИЯ?
- если дефект небольшой и нет признаков недостаточности кровообращения, то ребенку потребуется длительное наблюдение врача-кардиолога
- даже если дефект небольшой может развиться недостаточность кровообращения. В этом случае требуется обязательное лечение, т.к. сердце перестает справляться с нагрузкой.
- при большом дефекте, при отсутствии эффекта от лечения ребенку со временем потребуется операция для закрытия отверстия.
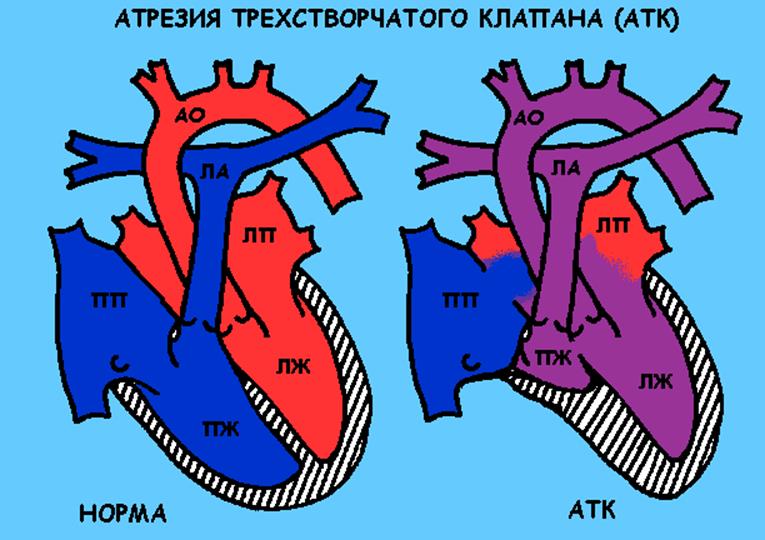
Атрезия трехстворчатого клапана (АТК)

Описание порока
Врожденный порок сердца «синего типа». В данном случае отсутствует сообщение между правым предсердием и правым желудочком. Кровь из правого предсердия через овальное окно попадает в левое предсердие (таким образом в левых отделах сердца появляется смешанная кровь), затем в левый желудочек. Из левого желудочка смешанная кровь идет в аорту и частично через дефект в межжелудочковой перегородке в правый желудочек, а оттуда в легочную артерию. Наличие дефектов (отверстий) в межпредсердной и межжелудочковой перегородке является принципиальным, чем меньше их размеры, тем хуже состояние ребенка и больше выражен цианоз (синий цвет кожи).
Лечение
Операция требуется в кратчайшие сроки при выраженном цианозе, в противном случае операция выполняется в течение первого года жизни.
Транспозиция магистральных сосудов
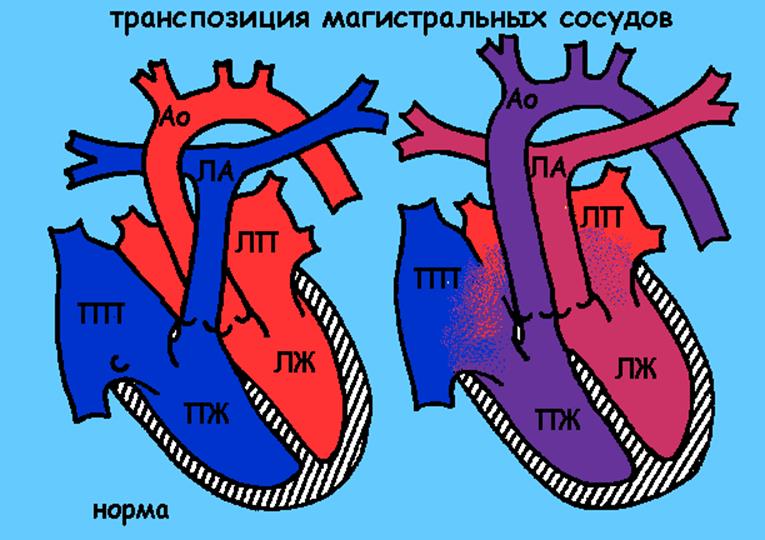
Описание порока
В норме о левого желудочка отходит аорта и несет богатую кислородом кровь ко всем органам и тканям, а от правого желудочка отходит легочная артерия, по которой кровь бедная кислородом попадает в легкие.
При ТМС – от левого желудочка отходит легочная артерия, и богатая кислородом кровь попадает в легкие, аорта отходит от правого желудочка и по ней течет кровь бедная кислородом. Жизнь в такой ситуации зависит от наличия и размеров открытого овального окна и открытого артериального протока. При отсутствии или закрытии этих отверстий организм ребенка не получает кислорода и очень быстро погибает. В результате нарушения кровообращения кожа ребенка приобретает синий цвет.
Лечение
При данном виде порока очень важно быстро поставить диагноз и направить ребенка к кардиохирургам. Без операции такие дети обречены на смерть в 100% случаев.
Атриовентрикулярный канал
Описание порока
Сложный врожденный порок сердца, при котором имеются отверстия в межпредсердной и межжелудочковой перегородке. Помимо этого, вместо 2-х атриовентрикулярных клапанов ( митрального и трехстворчатого), существует только 1 клапан в центре сердца. Результатом такого порока является смешивание крови, как в предсердиях, так и в желудочках сердца. Вследствие особенностей кровообращения, избыточное количество смешанной крови попадает в легкие (легкие «заливаются» кровью). У таких детей очень рано развивается недостаточность кровообращения и очень высок риск развития воспаления легких.
Лечение
Недостаточность кровообращения часто с трудом поддается терапевтическому лечению, дети плохо набирают вес. Радикальная операция выполняется в 3-4 месяца жизни. Если недостаточность кровообращения не удается контролировать лекарствами, а возраст ребенка и его вес не позволяют сделать радикальную операцию, то делают паллиативную (помогающую дожить до необходимого срока) коррекцию.
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК (ОАП)
В норме у плода имеется сосуд (артериальный проток), который соединяет аорту и легочный ствол. Через этот проток кровь плода минует легкие (которые во время беременности у ребенка не работают) и поступает в нижнюю половину туловища.
Описание порока
После рождения артериальный проток должен зарасти, если этого не происходит, то говорят о наличии у ребенка открытого артериального протока. Если проток открыт, то избыточное количество крови поступает через него в легочную артерию (так как давление в аорте выше чем в легочной артерии) , а оттуда в легкие. Таким образом резко увеличивается нагрузка на правые отделы сердца и легкие. Длительное существование ОАП приводит к необратимым изменениям в легких.
КАКОВЫ ПОСЛЕДСТВИЯ:
- Проток небольшой, недостаточности кровообращения нет, но ребенок обязательно должен находиться под наблюдением кардиолога. В данном случае существует вероятность самостоятельного закрытия сосуда.
Проток большой, сердце не справляется с нагрузкой, развивается недостаточность кровообращения, которая требует лечения. Со временем ребенку может потребоваться операция для перевязывания протока.
Источник
 В структуре младенческой смертности аномалии развития занимают третье место, и половину случаев летальности определяют врожденные пороки сердца (ВПС). Среди детей, умерших от ВПС и пороков развития крупных сосудов, 91% пациентов – это младенцы первого года жизни, из них 35% летальных исходов приходятся на ранний неонатальный период (до 6 дней). Около 70% детей умирают в течение первого месяца жизни [3, 4].
В структуре младенческой смертности аномалии развития занимают третье место, и половину случаев летальности определяют врожденные пороки сердца (ВПС). Среди детей, умерших от ВПС и пороков развития крупных сосудов, 91% пациентов – это младенцы первого года жизни, из них 35% летальных исходов приходятся на ранний неонатальный период (до 6 дней). Около 70% детей умирают в течение первого месяца жизни [3, 4].
Масштаб проблемы подчеркивает высокая частота ВПС: в разных странах этот показатель варьирует от 0,6% до 2,4% в год у детей, родившихся живыми, с учетом внутриутробной гибели плода и ранних выкидышей общая частота ВПС составляет 7,3% [1, 3].
Пренатальная диагностика. С целью снижения младенческой смертности используется пренатальный ультразвуковой скрининг, позволяющий выявить большинство ВПС до 24-й недели гестации. При подозрении на порок проводится прицельное УЗИ плода на аппарате экспертного класса. Основная задача – предотвратить рождение детей с неоперабельными пороками – синдромом гипоплазии левого сердца (СГЛС), гипертрофической кардиомиопатией с признаками органического поражения миокарда, множественными пороками развития плода. Пренатальный консилиум должен предложить прерывание беременности только при условии точной диагностики некурабельного порока [2, 4].
Классификация. В периоде новорожденности (иногда в первые дни, часы или минуты после рождения) манифестируют пороки, называемые критическими, так как они в 95-100% случаев сопровождаются жизнеугрожающими состояниями и определяют раннюю неонатальную летальность. К группе критических пороков относят транспозицию магистральных сосудов (ТМС), СГЛС, атрезию трикуспидального клапана или легочной артерии с интактной межжелудочковой перегородкой (МЖП), предуктальную коарктацию аорты, общий артериальный ствол, единственный желудочек, двойное отхождение магистральных сосудов от правого желудочка и другие [1, 5].
Учитывая высокую летальность новорожденных детей и младенцев от ВПС, для данной возрастной группы пациентов создана классификация, основанная на определении ведущего клинического синдрома, эффективности терапевтической тактики и определяющая сроки хирургического вмешательства [3, 4].
Синдромальная классификация ВПС у новорожденных и детей первого года жизни (Шарыкин А. С., 2005)
ВПС, проявляющиеся артериальной гипоксемией (хроническая гипоксемия, гипоксемический статус) – «дуктус-зависимые» пороки.
ВПС, преимущественно проявляющиеся сердечной недостаточностью (острая сердечная недостаточность, застойная сердечная недостаточность, кардиогенный шок).
ВПС, проявляющиеся нарушениями ритма сердца (полная атриовентрикулярная блокада, пароксизмальная тахикардия).
Данные состояния могут сочетаться, усугубляя тяжесть состояния детей, 50% этих детей требуют хирургического или терапевтического вмешательства на первом году жизни.
Гемодинамика. Критические пороки характеризуются дуктус-зависимым легочным или системным кровообращением, их объединяет внезапное резкое ухудшение внешне благополучного при рождении ребенка, связанное с уменьшением кровотока через артериальный проток. Дуктус-зависимое легочное кровообращение при ТМС, атрезии (или критическом стенозе легочной артерии) с интактной МЖП обеспечивает кровоток через проток в малый круг кровообращения, и при его ограничении или прекращении развивается тяжелая артериальная гипоксемия, острая гипоксия органов и тканей.
Клиника ВПС с легочным дуктус-зависимым кровообращением
Анатомия одного из самых частых критических пороков – транспозиции магистральных сосудов – заключается в неправильном отхождении аорты – из правого и легочной артерии – из левого желудочка, что способствует разобщению кругов кровообращения: в системе малого круга циркулирует артериальная кровь, в системе большого круга – венозная.
 Поступление кислорода к жизнеобеспечивающим органам возможно только при условии функционирующих фетальных коммуникаций – артериального протока, межпредсердного дефекта. Данное сообщение между кругами кровообращения не обеспечивает компенсации гипоксемии. С целью компенсации дефицита периферического кровообращения увеличивается минутный объем кровотока, возникает перегрузка малого круга (это происходит быстрее при наличии дефекта МЖП), быстро развивается легочная гипертензия. Именно поэтому в ходе ведения больного необходим постоянный контроль симптомов артериальной гипоксемии и мониторинг клинических признаков сердечной недостаточности (СН) – табл. 1.
Поступление кислорода к жизнеобеспечивающим органам возможно только при условии функционирующих фетальных коммуникаций – артериального протока, межпредсердного дефекта. Данное сообщение между кругами кровообращения не обеспечивает компенсации гипоксемии. С целью компенсации дефицита периферического кровообращения увеличивается минутный объем кровотока, возникает перегрузка малого круга (это происходит быстрее при наличии дефекта МЖП), быстро развивается легочная гипертензия. Именно поэтому в ходе ведения больного необходим постоянный контроль симптомов артериальной гипоксемии и мониторинг клинических признаков сердечной недостаточности (СН) – табл. 1.
Естественное течение порока очень тяжелое. Ребенок рождается в срок с нормальной массой тела, но в первые часы после рождения появляется диффузный цианоз кожи, особенно выраженный на периферии – цианоз лица, кистей, стоп. Состояние крайней степени тяжести обусловлено тяжелой артериальной гипоксемией. Одышка, тахикардия появляются через 1-2 часа после пережатия пуповины. Отмечается прогрессирующее ухудшение состояния. Ребенок вялый, заторможенный, легко охлаждается.
При закрытии фетальных коммуникаций острая гипоксия приводит к развитию полиорганной недостаточности и гибели новорожденного в течение нескольких часов. При выживании ребенка в течение нескольких недель нарастает сердечная недостаточность. Быстро развивается тяжелая гипотрофия. Необходимо отметить, что в случае адекватной тактики наблюдения и лечения, а также своевременной – до месяца – хирургической коррекции порока у ребенка (так как только в этот период возможна радикальная коррекция методом артериального переключения магистральных сосудов) полностью восстанавливается физиологическая гемодинамика, темпы роста и развития, физическая и в последующем социальная адаптация. Если коррекция порока проводится позже – исходы менее благоприятны.
Диагностические критерии ТМС включают:
Электрокардиографические признаки гипертрофии правого предсердия и правого желудочка – высокий зубец Р в «правых» отведениях – III, V1-3, глубокие зубцы S в «левых» – I, V5-6 и высокие зубцы R в отведениях III, V1-3.
Рентенологически определяется кардиомегалия и «овоидная» форма сердца с узким сосудистым пучком в результате совмещения контуров крупных сосудов (фото).
По данным эхокардиографии – параллельный ход выводных отделов желудочков – легочной артерии и аорты.
Гипероксидный тест отрицательный – при попытке подачи 100% кислорода через маску у больных с «синими» пороками через 10-15 минут рО2 возрастает не более чем на 10-15 мм рт. ст. (тогда как при болезнях легких рост рО2 составляет до 100-150 мм рт. ст.).
Схема обследования новорожденного ребенка с подозрением на ВПС:
осмотр больного (с оценкой симптомов гипоксемии и/или сердечной недостаточности);
оценка пульсации на всех конечностях;
аускультация сердца и легких (динамический контроль частоты сердечных сокращений, дыхания);
измерение артериального давления (АД) на всех конечностях (в дальнейшем динамический контроль).
Кроме того, наблюдение ребенка предполагает мониторинг газов крови (рО2, рСО2), сатурации кислорода (SatO2) с помощью пульсоксиметрии и метаболических показателей – рН, ВЕ. Газообмен в легких не нарушен, если РаО2 находится в пределах 60-80 мм рт. ст., SаО2 – 96-98%. Артериальная гипоксемия развивается при РаО2 менее 60 мм рт. ст. и уровне насыщения гемоглобина 85-75%.
Задачи педиатра (неонатолога):
обеспечить снижение потребностей организма в кислороде с помощью создания температурного и физического комфорта – условия кювеза, с возвышенным положением верхней части туловища;
пеленание со свободными грудной клеткой и руками;
ограничение энергетических затрат на физиологическую нагрузку (кормление через зонд);
поддержка кровотока через артериальный проток (инфузия жидкостей, простагландина Е);
коррекция метаболических сдвигов, при необходимости – искусственная вентиляция легких (ИВЛ) без добавления кислорода во вдыхаемую смесь, в режиме, исключающем гипервентиляцию и при одновременной инфузии препарата простагландина Е (расчет дозы препарата описан ниже). Принимая решение о назначении ИВЛ, необходимо учитывать, что кислород оказывает вазоконстрикторное влияние на артериальный проток, что делает кислородотерапию опасной в данной группе пациентов;
при угрозе закрытия дуктус-зависимых пороков объем инфузий и кормления увеличивают до 110-120% от нормальных потребностей на фоне постоянной оценки диуреза. Установлено, что прирост массы тела у новорожденного на 5% за 1-2 суток стабилизирует функцию артериального протока.
Транспортировка в кардиохирургический центр оптимальна в течение первых недель, первого месяца жизни. Предварительно необходимо сообщить в кардиохирургический стационар о больном с врожденным пороком сердца с дуктус-зависимым кровообращением. Период наблюдения до момента перевода и транспортировка в центр проводится на фоне инфузии препарата простагландина Е (Алпростан, Вазапростан).
Клиника ВПС с системным дуктус-зависимым кровообращением (группа пороков включает СГЛС, выраженную коарктацию аорты, перерыв дуги аорты). Наиболее позитивным примером пороков данной группы является выраженная предуктальная коарктация, занимающая от 1% до 10% среди критических ВПС. При данном пороке резко ограничен или полностью отсутствует кровоток из проксимальной ее части (ниже места отхождения артериального протока) к дистальной. Нарушение гемодинамики, соответственно, заключается в том, что в нисходящую аорту (в большой круг) небольшой объем крови поступает только из легочной артерии через артериальный проток. При закрывающемся артериальном протоке остро развивается гипоперфузия органов и тканей и полиорганная недостаточность. Клиника: доношенный новорожденный с резким ухудшением в первые несколько дней жизни – адинамия, холодные конечности, симптом гипоперфузии периферических тканей («белого пятна»), пульс малого наполнения, высокое АД на руках и низкое или не определяется на ногах, одышка, тахикардия, олигоурия с нарастающей азотемией, гепатомегалия с ростом трансаминаз, некротизирующий энтероколит.
Рассмотрим диагностику и оптимальную терапевтическую тактику в отношении пациента с выраженной коарктацией аорты на конкретном клиническом примере.
Доношенный новорожденный А., доставлен в реанимационное отделение в тяжелом состоянии: вялый, грудь не сосет, кожные покровы бледные, тахипноэ 120 в минуту, дыхание симметрично проводится по всем полям, хрипов нет. Тоны сердца звучные, 167 в минуту, нежный систолический шум в третьем межреберье слева от грудины, гепатомегалия (печень +5 см из-под края ребра, плотная). Диурез снижен, периферических отеков нет. АД на руках – 127/75 мм рт. ст., пульсация на бедренной артерии не определяется. SatO2 – 98%.
Из анамнеза: состояние ухудшилось внезапно на 14-е сутки жизни, когда ребенок стал вялым, появилась выраженная одышка, госпитализирован машиной «скорой помощи». Мальчик от второй, нормально протекавшей беременности, срочных родов с массой 3220 г, оценкой по шкале Апгар 5 (9) баллов. Выписан из родильного дома в удовлетворительном состоянии, находился на естественном вскармливании. Периодически отмечались эпизоды беспокойства, метеоризм.
При поступлении ребенок интубирован, проводится ИВЛ с низким содержанием кислорода во вдыхаемой смеси. Обследование в стационаре выявило кардиомегалию (кардиоторакальный индекс – 80%), обеднение легочного рисунка, по данным электрокардиографии – сочетанную перегрузку обоих желудочков. Эхокардиография установила гипоплазию аорты ниже места отхождения левой подключичной артерии (и выше локализации артериального протока), в типичном для артериального протока месте – точечный кровоток (закрывающийся артериальный проток). Через 6 часов состояние ребенка ухудшилось: развилась олигурия, отмечен рост креатинина до 213 ммоль/л, трансаминаз в 4-5 раз от уровня лабораторной нормы. Гуморальная активность не установлена.
Обоснование диагноза и тактики: учитывая клинику выраженной дыхательной и в последующем – полиорганной недостаточности в сочетании с кардиомегалией, системной артериальной гипертензией, почечной и печеночной недостаточностью, по клиническим данным следовало заподозрить коарктацию аорты. Внезапное ухудшение состояния ребенка в отсутствие признаков инфекции позволяет думать о дуктус-зависимом системном кровообращении, с учетом данных визуализации сердца и сосудов имеет место диагноз: «ВПС, предуктальная коарктация аорты, артериальная гипертензия 2 ст., вторичная, полиорганная недостаточность».
С момента подтверждения диагноза по данным ЭхоКГ необходимо начать терапию Вазапростаном 0,02 (с увеличением дозы до 0,05 мкг/кг/мин) с целью восстановления кровотока через артериальный проток. При данном пороке шунт направлен из легочной артерии в нисходящую аорту, и только эта небольшая порция крови обеспечивает весь большой круг кровообращения.
Расчет дозы и методика введения. Вес ребенка при поступлении – 3220 г. В 1 ампуле содержится 20 мкг Вазапростана. В данном случае введение препарата начали с дозы 0,02 мкг/кг/мин, то есть потребовалось 0,02 ´ 3,2 = 0,064 мкг/кг/мин. За час доза препарата составила 0,064 ´ 60 = 3,8 мкг/час. Для введения препарата 1 ампулу (20 мкг Вазапростана) развели в 20 мл физиологического р-ра (в 1 мл – 1 мкг). При отсутствии эффекта в течение двух часов доза была увеличена до 0,04-0,05 мкг/кг/мин: соответственно скорость введения препарата увеличилась до 7,6-9,5 мл/час. В данном случае был очень показателен контроль терапии – через 6 часов инфузии отмечено улучшение состояния, усиление дующего систолического шума во втором межреберье слева, увеличение размеров потока через артериальный проток по данным ЭхоКГ. Переведен на поддерживающую дозу Вазапростана – 0,01 и затем 0,005 мкг/кг/мин, которая сохранялась в течение всего периода наблюдения в педиатрическом стационаре и в ходе транспортировки при переводе в кардиохирургический стационар. В данном клиническом случае полностью отойти от ИВЛ было невозможно (учитывая тяжесть дыхательной недостаточности), на 5-й день госпитализации (19-е сутки жизни) ребенок на фоне терапии переведен в клинику им. Мешалкина, где была успешно проведена коррекция порока – формирование аортолегочного шунта.
В случаях развития сердечной недостаточности у новорожденных при пороках, сопровождающихся массивным сбросом крови в малый круг кровообращения, применяется тот же принцип мониторинга основных показателей и симптоматическая терапия:
ограничение введения жидкости по диурезу, в тяжелых случаях – до 1/3 возрастной нормы (но недопустимо ограничение жидкости до 50% от суточной физиологической потребности);
наличие объемной перегрузки требует применения диуретиков (при отечном синдроме предпочтение отдается Фуросемиду/Лазиксу в дозе 1-2 мг/кг; возможна комбинация с Верошпироном (1-3 мг/кг/сутки внутрь в 2-3 приема);
с целью купирования тахикардии (экономически невыгодный режим для миокарда и неэффективный объем для периферического кровообращения) используется Дигоксин (табл. 2).
При появлении симптомов перегрузки малого круга (аускультативно – усиление, расщепление 2-го тона на легочной артерии, на ЭхоКГ – увеличение давления в легочной артерии более 30 мм рт. ст. после шести суток жизни), а также признаков нарушения диастолической функции сердца рекомендуется применять препараты из группы ингибиторов ангиотензин-превращающего фермента (иАПФ). Используется Капотен (каптоприл) в дозе 0,5-1 мг/кг при условии контроля системного АД. Терапевтическое действие иАПФ связано со снижением периферического сопротивления сосудов и частичным депонированием крови, в результате чего уменьшается объем крови, возвращаемой в правые отделы сердца. Соответственно уменьшается объем шунта и нагрузка на левые камеры и сосуды малого круга. Кроме того, известно, что иАПФ являются ингибитором апоптоза, стимулированного гипоксией, что объясняет ангио- и кардиопротективный эффект препаратов.
Таким образом, тактика педиатра, включающая раннюю диагностику критических ВПС и терапию, управляющую внутрисердечной, центральной и периферической гемодинамикой, а также по возможности ранняя координация действий с кардиохирургическим центром способны существенно улучшить прогноз больных и уменьшить показатели младенческой смертности.
Литература
Бураковский В. А., Бухарин В. А., Подзолков В. П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия. Под ред. В. И. Бураковского, Л. А. Бокерия. М.: Медицина, 1989; 345-382.
Врожденные пороки сердца. Справочник для врачей. Под ред. Е. В. Кривошеева, И. А. Ковалева. Томск, 2009; 285.
Шарыкин А. С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. М.: Изд-во «Теремок», 2005; 384.
Шарыкин А. С. Перинатальная кардиология. Руководство для педиатров, кардиологов, неонатологов. М.: Изд-во «Теремок», 2007; 347.
Johnson Jr. W. H., Moller J. H. Pediatric cardiology. Core handbooks in pediatrics. LIPPUNCOTT WILLIAMS & WILKINS, 2001; 326.
Е. Ю. Емельянчик*, доктор медицинских наук, профессор
Д. Б. Дробот*, доктор медицинских наук, профессор
Е. П. Кириллова*, кандидат медицинских наук, доцент
В. А. Сакович*, доктор медицинских наук, профессор
Е. В. Басалова**
А. Ю. Черемисина*
*ГОУ ВПО Красноярский ГМУ им. профессора В. Ф. Войно-Ясенецкого,
**Краевая клиническая детская больница, Красноярск
Контактная информация об авторах для переписки: lenacor@mail.ru
Классификация СН у грудных детей с учетом проводимого лечения (А. С. Шарыкин, 2000)
Применение дигоксина у детей
Источник
