В открытом сосуде находится 90г газа

- Главная
- Вопросы & Ответы
- Вопрос 7073100
более месяца назад
Просмотров : 9
Ответов : 1
Лучший ответ:

Т.к. p – константа, значит это изобарный процесс
V2/V1=T2/T1
V=m/p(плотность)
m2p/m1p=T2/T1
m2/m1=T2/T1
m2/0.09=450/300
300m2=40.5
m2=0.135кг
Вычтем из m2 m1, получим 0.045кг
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
В каких из указанных слов не может быть приставки : день, поход, клюква, наклейка, пень, полет, ключик, выход?
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов : 1
Для ремонту школи заготували 288кг фарби.На фарбування підлоги витратили пяту восьмої всієї фарби.Скільки кілограмів фарби витратили на фарбування підлоги?
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Для пошива штор салон приобрел три куска глазета.В 1-ом куске было 25,16 м,во 2-ом на 32,71 м больше чем в первом,а в 3-ем на 0,7 м больше,чем во 2-ом.Сколько метров глазета в 3-ех кусках?
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
1)-Какой метод исследования наследования признаков выбрал Г.Мендель?
А)-близнецовый метод
Б)-гибридологический метод
В)-микроскопирование
Г)-методы клеточной инженерии
2)-Наука о закономерностях наследственности и изменчивости живых организмов называется:
А)…
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
С участка площадью 15 га собрали на 120 т картофеля больше,чем с участка площадью 9 га.Сколько картофеля собра
более месяца назад
Смотреть ответ
Просмотров : 5
Ответов : 1
Источник
5.4. Практическое применение уравнения состояния идеального газа
5.4.1. Уравнение состояния для идеального газа в открытом сосуде
При рассмотрении идеального газа, находящегося в открытом сосуде, необходимо учитывать, что вследствие изменения термодинамических параметров часть газа выходит из сосуда. При этом уравнение состояния записывается только для той части газа, которая остается в сосуде.
Для идеального газа, находящегося в открытом сосуде, необходимо учитывать следующее:
- масса газа изменяется в результате изменения его термодинамических параметров:
m ≠ const;
- рассматривается газ, оставшийся в сосуде определенного объема, т.е. объем газа фиксирован:
V = const;
- давление газа может изменяться или оставаться постоянным (в зависимости от условия задачи), причем на изменение давления в условии задачи обычно бывает четкое указание.
Если давление идеального газа в открытом сосуде по условию задачи изменяется (p ≠ const), то уравнение Менделеева — Клапейрона записывается для двух состояний газа в виде системы (рис. 5.7):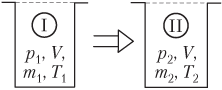
p1V=m1MRT1,p2V=m2MRT2,}
где p
1, m
1, T
1 — давление, масса и температура газа в начальном состоянии; p
2, m
2, T
2 — указанные параметры газа в конечном состоянии; V — объем сосуда; M — молярная масса газа; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К).
Если давление идеального газа в открытом сосуде по условию задачи остается постоянным (p = const), то изменения некоторых характеристик газа в открытом сосуде можно вычислить по следующим формулам:
- изменение массы
Δm=m1−m2=m1(1−T1T2),
где m
1 — первоначальная масса газа; m
2 — масса газа в конце процесса; T
1 — термодинамическая (абсолютная) температура газа в начале процесса; T
2 — термодинамическая (абсолютная) температура газа в конце процесса;
- изменение плотности
Δρ=ρ1−ρ2=ρ1(1−T1T2),
где ρ1 — первоначальная плотность газа; ρ2 — плотность газа в конце процесса;
- изменение количества вещества
Δν=ν1−ν2=ν1(1−T1T2),
где ν1 — первоначальное количество вещества (газа) в сосуде; ν2 — количество вещества (газа) в сосуде в конце процесса.
Пример 11. В открытом сосуде объемом 450 дм3 содержится некоторое количество идеального газа. Температуру газа увеличивают от 27 до 177 °С. Давление газа остается постоянным и равным 166 кПа. Сколько моль газа выйдет из сосуда?
Решение. Запишем уравнение Менделеева — Клапейрона для двух состояний газа, находящегося в открытом сосуде, при нагревании:
- для начального состояния
pV = ν1RT
1;
- для конечного состояния
pV = ν2RT
2;
где p — давление газа, p = const; V — объем газа (сосуда), V = const; ν1, ν2 — количество вещества (газа) в начале и в конце процесса; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1, T
2 — температура газа в начале и в конце процесса.
Первое уравнение позволяет получить формулу для расчета количества вещества (газа) в начале процесса:
ν1=pVRT1.
Подстановка полученной формулы в уравнение
Δν=ν1(1−T1T2)
дает искомую разность
Δν=pVRT1(1−T1T2)=pV(T2−T1)RT1T2.
Для вычисления искомой величины необходимо перевести температуру из градусов Цельсия в кельвины:
T
1 = t
1 + 273 = 27 + 273 = 300 К,
T
2 = t
2 + 273 = 177 + 273 = 450 К.
Произведем вычисление:
Δν=166⋅103⋅450⋅10−3(450−300)8,31⋅450⋅300=10 моль.
При нагревании из сосуда вышло 10 моль газа.
Пример 12. В баллоне при температуре 15 °С находится идеальный газ. Из баллона выходит 40 % газа, а температура при этом понижается на 8,0 °С. Во сколько раз уменьшится давление газа в баллоне?
Решение. Запишем уравнение Менделеева — Клапейрона для двух состояний газа, находящегося в открытом сосуде:
- для начального состояния
p
1V = ν1RT
1;
- для конечного состояния
p
2V = ν2RT
2;
где p
1 — давление газа в начальном состоянии; p
2 — давление газа в конечном состоянии; V — объем газа (сосуда), V = const; ν1, ν2 — количество вещества (газа) в начале и в конце процесса соответственно; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T
1, T
2 — температура газа в начале и в конце процесса соответственно.
Искомой величиной является отношение давлений p
1/p
2, которое определим из отношения уравнений:
p1Vp2V=ν1RT1ν2RT2, т.е. p1p2=ν1T1ν2T2.
В результате процесса из баллона выходит 40 % газа, поэтому количество вещества (газа) ν2, оставшегося в баллоне, составляет 60 % от количества вещества (газа) ν1, которое было в начале процесса:
ν2 = 0,6ν1.
Для вычисления искомой величины необходимо сделать перевод температуры, заданной в градусах Цельсия, в кельвины:
T
1 = t
1 + 273 = 15 + 273 = 288 К,
T
2 = t
2 + 273 = (t
1 − Δt) + 273 = (15 − 8,0) + 273 = 280 К.
Подстановка температур и количества вещества (газа), оставшегося в баллоне, в выражение для искомой величины дает
p1p2=ν1T10,6ν1T2=T10,6T2=2880,6⋅280=1,7.
Давление газа в баллоне понизится в 1,7 раза.
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
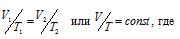
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
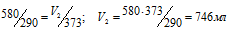
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:

Обозначив искомое давление газа через Р2, можно записать:
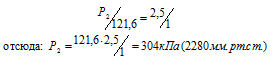
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:

По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
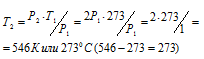
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
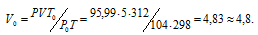
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
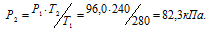
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
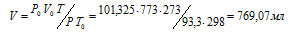
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
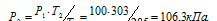
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
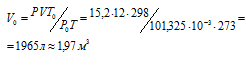
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
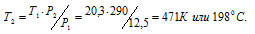
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
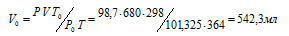
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:

где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
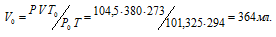
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
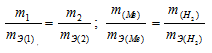
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
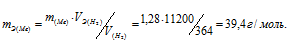
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
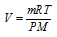
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
